Neumoencéfalo en posición semisentada: prevalencia, patrones y factores asociados
Liezel Ulloque-Caamaño, Alexander Zúñiga
Servicio de Neurocirugía, Hospital Ángel C. Padilla y Sanatorio 9 de Julio, Tucumán, Argentina
Recibido: 01/06/2024 Aceptado: 15/08/2024
Liezel Ulloque-Caamaño.
liucax1189@gmail.com
DOI: 10.59156/revista.v38i03.661
ORCID
Liezel Ulloque-Caamaño: 0000-0002-3973-3813
Alexander Zúñiga: 0009-0006-9094-5906
EMAILS
Alexander Zúñiga: alexander7zuniga17@gmail.com
Los autores no declaran conflicto de interés
Los autores no declaran financiamiento.
RESUMEN
Introducción: la posición semisentada (PSS) en neurocirugía es controversial por las complicaciones como el neumoencéfalo (NE); sin embargo tiene beneficios.
Objetivos: analizar aspectos del NE en pacientes con variedad de patologías de fosa posterior operados en posición semisentada.
Material y métodos: estudio transversal. Pacientes con patología de fosa posterior operados en PSS, entre enero del 2020 y junio del 2023. Se indagó sobre características demográficas, tipo y localización de la patología, derivación de líquido cefalorraquídeo prequirúrgico, localización y cantidad de apertura cisternal, lugar y apertura ventricular, tiempo quirúrgico, presencia de NE, patrones y grados, NE a tensión y resultado neurológico. Se consideró como significativo un valor p ≤0.05.
Resultados: 192 pacientes incluidos. Edad 47 ± 16.3 años, 62.5% fueron mujeres. NE 93.2%, sin NE a tensión. NE subdural (87.5%), subaracnoideo (66.6%), ventricular (15.6%). NE ˂40 años (86.4%), 40-60 (97.8%), ˃60 años (93.2%), p = 0.02. Los pacientes en edad entre los 40-60 años tienen 5.824 veces más riesgo de presentar NE que ˂40 años (OR 6.824, IC 95%; 1.395-33.380, p = 0.01). NE no se asoció con el resultado neurológico.
Conclusiones: la posición semisentada tiene alta prevalencia de NE postoperatorio y cero prevalencia de NE a tensión; se observa que a mayor edad existe mayor riesgo de NE. El uso de la PSS puede considerarse seguro.
Palabras clave: Base de cráneo. Neumoencéfalo. Neumoencéfalo a tensión. Posición semisentada.
Pneumoenphalus in semi-sitting position: prevalence, patterns and associated factors
ABSTRACT
Background. the semi-sitting position (SSP) in neurosurgery is controversial due to complications such as pneumocephalus (NE); however, it has benefits.
Objectives: to analyze aspects of NE in patients with a variety of posterior fossa pathologies operated in a semi-sitting position.
Methods: cross-sectional study. Patients with posterior fossa pathology operated in SSP, between January 2020 and June 2023. Demographic characteristics, type and location of the pathology, presurgical cerebrospinal fluid shunt, location and amount of cisternal opening, ventricular location and opening, surgical time, presence of NE, patterns and degrees, tension NE and neurological outcome were investigated. A p ≤0.05 value was shown to be significant.
Results: 192 patients included. Age 47 ± 16.3 years, women 62.5%. NE 93.2%, no tension NE. NE subdural (87.5%), subarachnoid (66.6%), ventricular (15.6%). NE ˂40 years (86.4%), 40-60 (97.8%), ˃60 years (93.2%), p = 0.02. Age 40-60 years has 5.824 times more risk of presenting NE than ˂40 years (OR 6.824, 95% CI; 1.395-33.380, p=0.01). NE does not compromise the neurological outcome.
Conclusions: the semi-sitting position has a high prevalence of postoperative NE with zero prevalence of tension NE; it is observed that the older the age, the greater the risk of NE. The use of PSS can be considered safe.
Keywords: Pneumocephalus. Semi-sitting position. Skull base. Tension pneumocephalus.
INTRODUCCIÓN
La posición semisentada (PSS) en neurocirugía sigue siendo controversial.1-3 Durante el siglo XX cayó en desuso por complicaciones reportadas tales como embolismo aéreo venoso, anoxia encefálica por hipotensión intraoperatoria y neumoencéfalo (NE).1 Sin embargo, alguno de sus beneficios son el drenaje gravitacional de la sangre y líquido cefalorraquídeo, generando un campo exangüe, sumándole una mejor visión anatómica de las estructuras.1-3
Es sabido que la PSS se relaciona con la aparición de NE postoperatorio en un porcentaje elevado de los casos,4,5 esto ha sido relacionado con la pérdida de líquido cefalorraquídeo (LCR) y los efectos hidrostáticos que esta pérdida genera.5 Sopesando las teorías fisiopatológicas del NE con esta posición quirúrgica,6 son escasos los trabajos en la literatura que evalúan su prevalencia, patrones, factores relacionados con su aparición y su significancia clínica en forma de NE a tensión.
El trabajo de la escuela de Tübingen sobre este tópico es el único que analiza la aparición de NE en una serie de pacientes operados de schwannomas vestibulares (SV).5 Sin embargo, no existen trabajos en la literatura que estudien el NE postoperatorio en pacientes con diversas patologías de la fosa posterior. Nuestro equipo se propuso analizar diversos aspectos del neumoencéfalo en pacientes con una variedad de patologías de fosa posterior operados en PSS.
OBJETIVOS
Determinar la prevalencia de NE y su variante a tensión; presentar los patrones y grados del NE y establecer la relación entre el NE y distintas variables asociadas en pacientes con patología neuroquirúrgica de fosa posterior operados en PSS.
MATERIAL Y MÉTODOS
Pacientes
Estudio observacional, descriptivo, de corte transversal con recolección prospectiva de datos de pacientes con patología neuroquirúrgica de fosa posterior operados en PSS en dos instituciones en Tucumán, Argentina, durante el período entre enero del 2020 y junio del 2023 (n = 200). Se incluyeron pacientes con adecuado seguimiento clínico-radiológico y que desearon participar del estudio, previo consentimiento informado (N = 192). Se excluyeron aquellos con inadecuado seguimiento (n = 8). Trabajo con aprobación del comité de ética de ambas instituciones.
Recolección de datos
Los datos fueron recolectados de la historia clínica, protocolos quirúrgicos, sistema de imágenes de cada institución y registro audiovisual de cada cirugía. Se registraron características demográficas, tipo y localización de la patología, derivación de LCR prequirúrgico, localización de apertura de cisternas y número de cisternas abiertas, apertura ventricular y lugar de apertura, tiempo quirúrgico, presencia de NE, patrones y grados de este, NE a tensión y resultados neurológicos a los 30 días de la cirugía.
Variables
Características demográficas
Características prequirúrgicas
Características intraquirúrgicas
Seguimiento radiológico
Se utilizó protocolo de tomografía computada (TC) estándar, con cortes de 1 mm de espesor con ventana ósea y parenquimatosa, cortes axial, coronal y sagital. En todos los casos se realizó una TC preoperatoria y al menos una TC dentro de las primeras 24 horas postoperatorias.
Se analizó en esta última:
Presencia de NE: se calculó la prevalencia de NE postquirúrgico en la población estudiada.
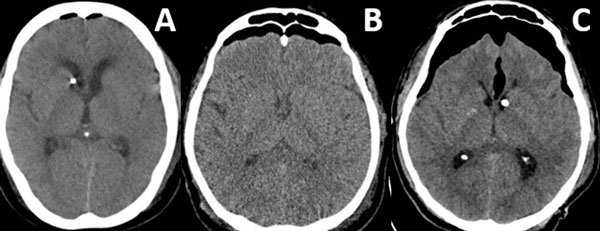
Patrones y grados de NE: NE subdural (Figura 1), se clasificó en 3 grados: leve (menor al espesor óseo), moderado (entre una vez y dos veces el espesor óseo) y severo (dos o más veces el espesor óseo). NE subaracnoideo (Figura 2), se clasificó en 3 grados: leve (confinado a cisternas basales), moderado (cisternas supratentoriales predominio unilateral), severo (generalizado). NE ventricular (Figura 3), se clasificó en: leve (en IV y/o III ventrículo), moderado (alcanzó VL), severo (alcanzó y dilató los VL).
Presencia de NE a tensión: prevalencia de NE a tensión postquirúrgico en la muestra. Este se definió como la presencia de aire intracraneal evidenciado en TC asociado a signos de hipertensión endocraneana.
Resultado neurológico a los 30 días de la cirugía: se evaluó el resultado neurológico a los 30 días postquirúrgicos mediante la Glasgow Outcome Scale (GOS).7

Figura 1. Neumoencéfalo subdural. A) Leve. B) Moderado. C) Severo.

Figura 2. Neumoencéfalo subaracnoideo. A) Leve. B) Moderado. C) Severo.

Figura 3. Neumoencéfalo ventricular. A) Leve. B) Moderado. C) Severo.
Análisis estadístico
El análisis estadístico fue realizado con EPI INFO 7.2. Los datos cuantitativos se consideraron de distribución normal por el tamaño de la muestra y según el teorema del límite central y se expresan en medias (X̄) con su desviación estándar (DE), y los cualitativos en valor absoluto y porcentajes. Las diferencias porcentuales se evaluaron con χ2, las de medias con el método de Anova. Se realizó regresión logística entre NE y los diversos factores que resultaron significativos en el análisis bivariado. Un valor de p ≤0.05 es estadísticamente significativo.
RESULTADOS
Características demográficas
Un total de 192 pacientes fueron incluidos en el análisis de los resultados, tenían una edad media de 47 ± 16.3 años, 30.7% (n = 59) tenían menos de 40 años, 46.5% (n = 89) entre 40-60 años y el 22.8% (n = 44) eran mayores de 60 años. El 62.5% eran de sexo femenino (n = 120).
Características prequirúrgicas
En la Tabla 1 se muestran las características de la patología, así como la necesidad prequirúrgica de algún procedimiento para derivación del LCR.
TABLA 1. CARACTERÍSTICAS PREQUIRÚRGICAS
Localización de la patología, n (%) Intraaxial Extraxial |
36 (18.7) |
Tipo de patología, n (%) |
|
Necesidad de TVE prequirúrgico, n (%) |
9 (4.7) |
Necesidad Shunt VP prequirúrgico, n (%) |
9 (4.7) |
Necesidad DVE prequirúrgico, n (%) |
17 (8.9) |
TVE: Tercera ventriculostomía endoscópica. VP: Ventriculoperitoneal. DVE: Derivación ventricular externa.
Características intraquirúrgicas
En el 100% de los pacientes se abrió alguna cisterna, en la Tabla 2 se observan la localización y cantidad de cisternas abiertas, la apertura ventricular y su lugar de apertura, así como la duración de la cirugía.
TABLA 2. CARACTERÍSTICAS INTRAQUIRÚRGICAS
Localización de cisternas abiertas, n (%) |
|
Numero de cisternas abiertas, X̄ ± DE |
2.1 ± 1.1 |
Cantidad de cisternas abiertas, n (%) |
|
Apertura ventricular, n (%) |
|
Lugar de apertura ventricular, n=26 n (%) |
|
Duración en minutos de cirugía, X̄ ± DE |
342.4 ± 248 |
Intervalo de duración de cirugía, n (%) |
|
Prevalencia, patrón y grados de neumoencéfalo postoperatorio
En la Figura 4 se muestra la prevalencia de NE. La Tabla 3 presenta la frecuencia de los patrones de neumoencéfalo y sus grados.

Figura 4. Prevalencia de neumoencéfalo postquirúrgico en cirugías de patologías de fosa posterior en posición semisentada. N = 192
TABLA 3. PATRÓN Y GRADOS DE NEUMOENCÉFALO
|
Grado |
|||
Patrón |
Ausente |
Leve |
Moderado |
Severo |
Subdural, n (%) |
|
|
|
|
Subaracnoideo, n (%) |
|
|
|
|
Ventricular, n (%) |
|
|
|
|
Neumoencéfalo a tensión
En este trabajo no se presentaron casos de neumoencéfalo a tensión.
Neumoencéfalo y su relación con diversos factores
Edad
Se observó que en mayores de 40 años la presencia de NE posquirúrgico fue mayor que en los menores de 40 años, la mayor frecuencia fue entre los 40 y 60 años (p = 0.02). La presencia de NE ventricular moderado fue más elevada en mayores de 60 años, y fue menor en los menores de 60 años (p = 0.03) (Tablas 4 y 5). La media de edad fue mayor en los que presentaron neumoencéfalo subdural (p = 0.01), en los que tenían un mayor grado de este (p = ˂0.001) y en los que tenían neumoencéfalo subaracnoideo (p = 0.03). En los que no presentaron NE ventricular la media de edad fue menor (p = 0.03), y fue estadísticamente significativo. Así se puede inferir que, a mayor edad, mayor presencia del NE postquirúrgico en general y en especial ventricular, más que todo el grado moderado, y que el promedio de edad mayor se vio en NE subdural, en el grado severo, y en el NE subaracnoideo (Tabla 6).
TABLA 4. PRESENCIA DE NEUMOENCÉFALO SEGÚN EDAD
|
Neumoencéfalo |
Sin neumoencéfalo |
Valor p* |
Menos de 40 años, n (%) |
51 (86.4) |
8 (13.6) |
0.02ᶧ |
Entre 40 y 60 años, n (%) |
87 (97.8) |
2 (2.3) |
|
Mas a 60 años, n (%) |
41 (93.2) |
3 (6.8) |
*Chi cuadrado. ᶧSignificativo.
TABLA 5. PRESENCIA DE GRADOS DE NEUMOENCÉFALO VENTRICULAR SEGÚN EDAD
|
Ausente |
Leve |
Moderado |
Severo |
Valor p* |
Menos de 40 años, n (%) |
48 (81.3) |
1 (1.7) |
5 (8.5) |
5 (8.5) |
0.03ᶧ |
Entre 40 y 60 años, n (%) |
79 (88.7) |
1 (1.1) |
7 (7.9) |
2 (2.3) |
|
Más de 60 años, n (%) |
35 (79.5) |
4 (9.1) |
5 (11.4) |
0 |
*Chi cuadrado. ᶧSignificativo.
TABLA 6. MEDIA DE EDAD SEGÚN TIPO DE NEUMOENCÉFALO Y GRADOS
|
X̄ ± DE |
Valor p* |
Neumoencéfalo subdural |
|
0.01ᶧ |
Grados de neumoencéfalo subdural |
|
˂0.001ᶧ |
Neumoencéfalo subaracnoideo |
|
0.03ᶧ |
Grados de neumoencéfalo ventricular |
|
0.03ᶧ |
*Anova. ᶧSignificativo.
Sexo
Con respecto al sexo, en este trabajo no hubo diferencia significativa en la frecuencia de NE postquirúrgico entre hombres y mujeres (n = 112 NE/120 H-93.1%, versus n = 67 NE/72 M-93.3%, respectivamente, p = 0.9).
Patología extraaxial e intraaxial
Los pacientes con patología extraaxial presentaron mayor NE, sin ser estadísticamente significativo (p = 0.2), al evaluar el patrón y grado de NE, se observa mayor presencia de neumoencéfalo subdural (p = 0.05) y subaracnoideo (p = 0.04) en la patología extraaxial, y mayor NE ventricular severo y moderado (p = 0.01) en la patología intraaxial, esto es estadísticamente significativo (Tabla 7).
TABLA 7. PRESENCIA, PATRÓN Y GRADO DE NEUMOENCÉFALO SEGÚN LOCALIZACIÓN DE PATOLOGÍA
|
Extraaxial |
Intraaxial |
Valor p* |
Neumoencéfalo, n (%) |
|
|
0.2 |
Neumoencéfalo subdural, n (%) |
|
|
0.05ᶧ |
Neumoencéfalo subaracnoideo, n (%) |
|
|
0.04ᶧ |
Grados de neumoencéfalo ventricular, n (%) |
135 (86.5) |
27 (75.0) |
0.01ᶧ |
*Chi cuadrado. ᶧSignificativo.
Patología tumoral y no tumoral
Se observó mayor presencia de NE en la patología tumoral (p = 0.1) sin ser estadísticamente significativo, sí se observó diferencia significativa en el NE subaracnoideo severo que fue mayor en la patología no tumoral (p = 0.01) y en el NE ventricular (p = 0.001) en todos sus grados (p = 0.01) siendo más frecuente en la patología tumoral (Tabla 8).
TABLA 8. PRESENCIA, PATRÓN Y GRADO DE NEUMOENCÉFALO SEGÚN TIPO DE PATOLOGÍA
|
No tumoral |
Tumoral |
Valor p* |
Neumoencéfalo, n (%) |
|
|
0.1 |
Grados de neumoencéfalo subaracnoideo, n (%) |
31 (37.8) |
33 (30.0) |
0.01ᶧ |
Neumoencéfalo ventricular, n (%) |
77 (93.9) |
85 (77.3) |
0.001ᶧ |
Grados de neumoencéfalo ventricular, n (%) |
77 (93.9) |
85 (77.3) |
0.01ᶧ |
*Chi cuadrado. ᶧSignificativo.
Derivación de LCR previo a cirugía
La presencia de neumoencéfalo en los que no requirieron procedimientos para derivación de LCR prequirúrgico (n = 164) fue del 92.7% (n = 152), y en los que sí requirieron (n = 28) fue del 96.4% (n = 27), esta diferencia no es estadísticamente significativa (p = 0.4).
Apertura de cisternas basales
Se presentó mayor frecuencia de NE en los pacientes en los que se abrieron las cisternas laterales (p = 0.04). El NE ventricular y su grado severo fue mayor con la apertura de ambas cisternas (p = 0.001) (Tabla 9). El promedio de cisternas abiertas fue mayor en los que tuvieron NE (2.1 ± 1.0) que en los que no tuvieron (2.0 ± 1.1) (p = 0.6), esto no es estadísticamente significativo. Sin embargo, el promedio de cisternas abiertas fue mayor en los que tuvieron NE ventricular (2.7 ± 1.0), que en los que no tuvieron (1.9 ± 1.0) (p = ˂0.001), y a mayor cantidad de cisternas abiertas mayor grado de NE ventricular, así: ausente (1.9 ± 1.0), leve (2.5 ± 1.2), moderado (2.7 ± 1.0), severo (2.8 ± 0.6) (p = 0.004), siendo significativa la diferencia.
TABLA 9. PRESENCIA, PATRÓN Y GRADO DE NEUMOENCÉFALO SEGÚN LOCALIZACIÓN DE CISTERNAS ABIERTAS
|
Cisternas mediales |
Cisternas laterales |
Ambas |
Valor p* |
Neumoencéfalo, n (%) |
|
|
|
0.04ᶧ |
Neumoencéfalo ventricular, n (%) |
|
|
|
0.001ᶧ |
Grados neumoencéfalo ventricular, n (%) |
17 (73.9) |
129 (89.5) |
16 (64.0) |
0.006ᶧ |
* Chi cuadrado. ᶧSignificativo.
Apertura ventricular
El NE ventricular se presentó en todos los casos con apertura ventricular, independientemente del lugar de apertura (p ˂0.001), la mayoría en sus formas fue moderada y severa (p ˂0.001), el grado severo fue mayor con apertura del cuarto ventrículo (p ˂0.001), siendo estadísticamente significativo (Tablas 10 y 11). El NE subdural fue mayor con apertura ventricular por los agujeros de Lushka y Magendi (p = 0.01), y sus grados moderado y severo se presentaron con más frecuencia con apertura del ventrículo por el agujero de Magendi (p = 0.05), la diferencia es estadísticamente significativa (Tabla 11).
TABLA 10. PRESENCIA, PATRÓN Y GRADO DE NEUMOENCÉFALO SEGÚN APERTURA VENTRICULAR
|
Apertura ventricular |
Valor p* |
|
No |
Sí |
|
|
Neumoencéfalo, n (%) |
|
|
0.1 |
Neumoencéfalo ventricular, n (%) |
|
|
˂0.001ᶧ |
Grados de neumoencéfalo ventricular, n (%) |
162 (97.6) |
0 |
˂0.001ᶧ |
*Chi cuadrado. ᶧSignificativo.
TABLA 11. PRESENCIA, PATRÓN Y GRADO DE NEUMOENCÉFALO SEGÚN LOCALIZACIÓN DE APERTURA VENTRICULAR
|
IV ventrículo |
Lushka |
Magendi |
Sin apertura |
Valor p* |
Neumoencéfalo, n (%) |
|
|
|
|
0.5 |
Neumoencéfalo subdural, n (%) |
|
|
|
|
0.01ᶧ |
Grados de neumoencéfalo subdural, n (%) |
|
|
|
|
0.05ᶧ |
Neumoencéfalo ventricular, n (%) |
|
|
|
|
˂0.001ᶧ |
Grados de neumoencéfalo ventricular, n (%) |
|
|
|
|
˂0.001ᶧ |
*Chi cuadrado. ᶧSignificativo.
Tiempo quirúrgico
Hubo una mayor duración de la cirugía en minutos en los pacientes que presentaron NE (347.9 ± 253.0) que en aquellos que no presentaron (265.3 ± 146.8), sin diferencia significativa (p = 0.2). Al discriminar según patrón y grado de NE se observó que el NE subaracnoideo tenía diferencia significativa de acuerdo a su grado y el tiempo en minutos de duración, de esta manera: ausente (317.3 ± 233.3), leve (356.5 ± 198.1), moderado (393.9 ± 331.6), severo (250.8 ± 116.8), el tiempo en el NE subaracnoideo moderado fue mayor (p = 0.01). Y con respecto al NE subdural, cuando la cirugía fue de una duración menor a 3 horas se presentó en el 71.4% (n = 15), entre 3 y 6 horas en el 88.3% (n = 98), y cuando duró más de 6 horas se presentó en el 91.7% (n = 55) (p = 0.05), así el neumoencéfalo subdural tuvo mayor frecuencia cuando la cirugía duro más de 6 horas, siendo estadísticamente significativo. En algunos patrones de NE, el tiempo de cirugía podría influir en la aparición de NE postquirúrgico.
Resultado neurológico a 30 días
Con respecto al resultado neurológico a los 30 días postquirúrgicos según la escala de GOS se observó que la mayoría 68.7% (n = 132) era normal, 16.7% (n = 32) tenían déficit moderado, 5.7% (n = 11) déficit severo, y solo el 1.6% (n = 3) estaba en estado vegetativo y el 7.3% (n = 14) falleció. No hubo diferencias significativas en el resultado neurológico a los 30 días postquirúrgicos entre los que presentaron, o no, neumoencéfalo (p = 0.23).
Se observó que la edad es un posible factor de riesgo para la presencia de NE postquirúrgico en general, la población entre 40 y 60 años tenían 5.82 veces más riesgo de ocurrencia que los menores de 40 años, esto es estadísticamente significativo (p = 0.01) (Tabla 12); también lo fue para el NE subdural y subaracnoideo (p = 0.02 y 0.04, respectivamente) (Tablas 13 y 14). Para el NE subdural, además, se vio que en pacientes con cirugía de más de 6 horas tenían 3.4 veces más riesgos de tener este tipo de NE que en los que su cirugía había demorado menos de 3 horas (p = 0.02) (Tabla 13). Los pacientes con patología tumoral presentaron 3.52 veces más riesgo de presentar NE ventricular que los que no tenían patología tumoral (p = 0.03), también abrir las cisternas mediales o, tanto las mediales como laterales, se asociaba a mayor riesgo de NE ventricular que solo abrir las cisternas laterales (p = 0.04 y 0.002, respectivamente) (Tabla 15).
TABLA 12. FACTOR DE RIESGO ASOCIADO A NEUMOENCÉFALO EN PACIENTES POSTQUIRÚRGICOS DE PATOLOGÍA DE FOSA POSTERIOR OPERADOS EN POSICIÓN SEMISENTADA
Factor |
Neumoencéfalo |
||
OR |
IC 95% |
Valor p* |
|
Edad |
|
1.395-33.380 |
0.01ᶧ |
*Valor p calculado por Test de Wald. ᶧSignificativo.
TABLA 13. FACTOR DE RIESGO ASOCIADO A NEUMOENCÉFALO SUBDURAL EN PACIENTES POSTQUIRÚRGICOS DE PATOLOGÍA DE FOSA POSTERIOR OPERADOS EN POSICIÓN SEMISENTADA
Factor |
Neumoencéfalo subdural |
||
OR |
IC 95% |
Valor p* |
|
Edad, X̄ |
1.033 |
1.005-1.062 |
0.02ᶧ |
Intervalo de duración de cirugía |
|
0.994-9.145 |
0.05 |
*Valor p calculado por Test de Wald. ᶧSignificativo.
TABLA 14. FACTOR DE RIESGO ASOCIADO A NEUMOENCÉFALO SUBARACNOIDEO EN PACIENTES POSTQUIRÚRGICOS DE PATOLOGÍA DE FOSA POSTERIOR OPERADOS EN POSICIÓN SEMISENTADA
Factor |
Neumoencéfalo subaracnoideo |
||
OR |
IC 95% |
Valor p* |
|
Edad, X̄ |
1.020 |
1.000-1.039 |
0.04ᶧ |
*Valor p calculado por Test de Wald. ᶧSignificativo.
TABLA 15. FACTOR DE RIESGO ASOCIADO A NEUMOENCÉFALO VENTRICULAR EN PACIENTES POSTQUIRÚRGICOS DE PATOLOGÍA DE FOSA POSTERIOR OPERADOS EN POSICIÓN SEMISENTADA
Factor |
Neumoencéfalo ventricular |
||
OR |
IC 95% |
Valor p* |
|
Tipo de patología |
|
1.652-12.417 |
0.003ᶧ |
Localización de cisternas abiertas |
|
1.038-8.879 |
0.04ᶧ |
*Valor p calculado por Test de Wald. ᶧSignificativo.
DISCUSIÓN
Neumoencéfalo y características demográficas
Se ha descripto en la literatura una relación entre mayor edad y sexo masculino con el riesgo de NE postoperatorio con PSS de patologías de fosa posterior. En el presente estudio se pudo ver que a mayor edad mayor riesgo de NE, sin embargo, no se encontraron diferencias estadísticamente significativas con respecto al sexo, a diferencia del estudio de Machetanz y cols., donde sí se observó esta influencia. Se cree que la mayor tendencia a la atrofia parenquimatosa asociada a la edad y, particularmente, en sujetos masculinos, así como el mayor volumen de LCR en estos, pueden ser factores contribuyentes a un mayor NE.4,5,8-12
Neumoencéfalo y localización de la patología
La aparición de NE subdural y subaracnoideo se relacionó con la patología extraaxial, mientras que el NE ventricular moderado y severo con la intraaxial, esto resulta de significancia estadística. A este respecto, una serie de Himes y cols. de 1792 pacientes en la que se evaluó la tasa de complicaciones asociadas a la PSS clasificó el tipo de lesiones tratadas en: patología craneal con abordaje suboccipital en posición sentada (n: 450) y colocación de estimuladores cerebrales profundos (DBS) (n: 332); y patología cervical abordada en la misma posición (n: 1010), haciendo la salvedad del origen intradural y extradural de la lesión. Pudieron concluir que la tasa general de complicaciones fue del 3.3%, y en los procedimientos suboccipitales la presencia de NE a tensión fue del 0.2%, mientras que los procedimientos cervicales intradurales se asociaron con mayor riesgo de NE a tensión en relación con los procedimientos extradurales, esto es estadísticamente significativo.3
Por otro lado, en una cohorte retrospectiva se estudiaron los predictores de NE ventricular en pacientes con patología de fosa posterior e intervenidos en PSS, localizaron un 40% de las lesiones a nivel cerebeloso y un 19% en el ángulo pontocerebeloso y el clivus, sin hacer otra observación respecto de la localización de las lesiones. La relación de NE y la localización de la patología –si bien ya ha sido abordada– presenta poca referencia bibliográfica que permita una clasificación más taxativa, por eso el valor de los resultados que planteamos en este trabajo.4,5
Neumoencéfalo y tipo de patología
Respecto de esta relación, no hay evidencia en la literatura del tipo de patología (tumoral y no tumoral) y NE en el contexto de cirugía en PSS sino, más bien, las series abordan solo uno de los tipos de patología, en su mayoría la tumoral, para realizar sus investigaciones.5,9 A propósito de esto, el trabajo de Machetanz-Tatagiba ha aportado una de las series con mayor reclutamiento de pacientes con schwannomas vestibulares operados en PSS en comparación con la posición en decúbito supino y su vínculo con el NE.5 De manera similar, Sloan y cols. hicieron lo mismo con los tumores de fosa posterior.9 Así, Machetanz-Tatagiba plantearon en su metodología que pacientes con tumores Hannover T1 y T2 fueran operados en posición supina, mientras que los tumores Hannover T3 y T4 se operaran en PSS. Concluyen que aquellos tumores Hannover T4 son predictores negativos para NE postoperatorio (B = -9.79, IC del 95% [-15.66 a -3.93], β = -0.139, p = 0.001) ya que estos, por su tamaño, pueden ocluir el agujero ipsilateral de Lushka evitando, así, la mayor pérdida de LCR a partir del cuarto ventrículo durante la cirugía, en comparación con casos con tumores Hannover T3 en las mismas circunstancias.5
En el presente estudio se observa una relación estadísticamente significativa en NE subaracnoideo severo, el cual fue mayor en la patología no tumoral y el NE ventricular en todos sus grados, el cual fue mayor en la patología tumoral.
Neumoencéfalo y derivación de LCR prequirúrgico
Los tumores de fosa posterior, en ocasiones, se asocian a hidrocefalia obstructiva que suele resolverse tras su exéresis, pero algunos pacientes requieren intervenciones como derivaciones de LCR previas para aliviar síntomas agudos de la hidrocefalia. Este estudio observó que el 96.4% de los pacientes que requirieron derivación de LCR prequirúrgica desarrollaron NE, en comparación al estudio de Polemikos y cols. en donde el 100% de los pacientes operados bajo estas circunstancias presentaron NE. Al igual que en ese estudio, ninguno de nuestros casos fue a tensión.8 Es controversial el uso de la PSS para este tipo de pacientes y bajo estas circunstancias, ya que algunos autores relatan mayor riesgo de neumoencéfalo sintomático y hematomas intracraneanos postquirúrgicos;9,13-16 sin embargo, otros demuestran que la cirugía de patología de fosa posterior en PSS es factible con un riesgo perioperatorio relativamente bajo con respecto al NE sintomático.8 Nosotros observamos que la derivación de LCR prequirúrgica podría no ser un factor de riesgo para la aparición de NE en pacientes operados de patología de fosa posterior en PSS.
Sin embargo, tras esta controversia, si se indicara una derivación ventriculoperitoneal prequirúrgica, debería usarse una válvula regulable antigravitacional, ya que disminuye el sobredrenaje en los cambios posturales. Por otro lado, si el paciente tiene una válvula no regulable podría considerarse su reemplazo por una regulable, más dispositivo antisifón antes de la cirugía de fosa posterior en PSS, esto cuando exista baja probabilidad de que la hidrocefalia se resuelva en el postoperatorio, o se anticipe un sobredrenaje, por ejemplo, los pacientes derivados con un cociente de Evans preoperatorio >0.3 debido a su mayor susceptibilidad a presentar mayores NE postoperatorios.17-19 En pacientes con válvulas programables con NE postquirúrgico puede ajustarse su presión de apertura y este ajuste depende de la clínica del paciente más que del volumen de NE. Otras opciones de tratamiento pueden ser ligadura de catéter distal, o el reemplazo de aire por suero fisiológico.5,20
Neumoencéfalo y apertura de cisternas basales
Asimismo, como lo hemos advertido previamente, son escasos los reportes que específicamente traten la apertura de cisternas como una variable a considerar a la hora de hablar de NE en PSS. Un estudio que realizó la apertura de la cisterna cerebelopontina sistemáticamente en abordajes retrosigmoideos para el tratamiento de SV teoriza que la apertura de las cisternas basales, y/o del cuarto ventrículo a nivel del agujero de Lushka y Magendi, podría facilitar el drenaje del LCR, aumentando correspondientemente su efecto de sifón incrementando, así, el volumen del NE en el postoperatorio, sobre todo en su forma subdural. Esto por el hecho de que el NE no aumenta significativamente en las cirugías de estimulación cerebral profunda, pese a realizarse en PSS.5 El papel de la apertura de las cisternas es, entonces, preponderante. En nuestro estudio observamos significancia estadística en que el aumento del número de cisternas abiertas intraoperatoriamente no solo aumenta la frecuencia de NE, sino que favorece la aparición de NE ventricular en grado severo, además que abrir las cisternas mediales, o tanto las mediales como las laterales, era riesgo de NE ventricular, en comparación a cuando solo se abrían las cisternas laterales.
Neumoencéfalo y apertura ventricular
La exposición quirúrgica del sistema ventricular en el intraoperatorio aumenta, lógicamente, el riesgo de NE ventricular (OR 34.7; IC 95% [4.4; 273.5]; p = 0.001). Además, el mayor volumen de NE ventricular, tanto en pacientes sintomáticos como asintomáticos, fue visto en lesiones localizadas en el cuarto ventrículo, mientras que volúmenes más bajos correspondieron con cirugía del ángulo pontocerebeloso.4 En un estudio de 2018, que enlistó población pediátrica y adultos, el análisis de regresión reveló que un mayor NE ventricular se asoció con la apertura de los ventrículos en todos los pacientes de la serie. También, la mayor proporción de casos de NE ventricular a tensión fueron secundarios a lesiones cerebelosas con apertura del cuarto ventrículo, seguido de lesiones del cuarto ventrículo per se.4 Por todo esto es importante mencionar que la apertura del cuarto ventrículo es el predictor más importante para el NE ventricular a tensión o sus grados severos (OR = 34.7, CI 95% [4.4–273.5], p = 0.001).4 En consonancia con esto, hallamos relación entre NE ventricular y apertura del sistema (p ˂0.001) y, específicamente con la apertura del cuarto ventrículo se presentó en sus formas moderada y severa (p ˂0.001). Por su parte, el NE subdural se presentó más frecuentemente con la apertura del ventrículo por los agujeros de Lushka y Magendi (p = 0.01), y su grado moderado y severo se dio con más frecuencia cuando se abrió el ventrículo por el agujero de Magendi (p = 0.05).
Por otro lado, evidenciamos mayor presencia de NE ventricular moderado en mayores de 60 años, y el NE ventricular fue menor en los menores de 60 años, siendo estadísticamente significativo (p = 0.03), en consonancia con otros autores.5
Neumoencéfalo y tiempo quirúrgico
En este aspecto, es importante mencionar que el NE puede tener relación con la extensión del tiempo quirúrgico ya que hallamos que un mayor tiempo quirúrgico aumenta correspondientemente la frecuencia de NE subaracnoideo moderado y en cirugías de más de 6 horas, la prevalencia de NE subdural fue mayor en comparación con aquellas cirugías menores a ese tiempo. Paralelamente, los valores medios de otras series toman tiempos quirúrgicos similares, aquellas cirugías con tiempo intradural superior a 4.5 horas y realizados en pacientes de mayor edad han demostrado correlación con el aumento del NE postoperatorio.5
Otras series han considerado tiempos quirúrgicos más prolongados, donde la duración media fue de 7.2 horas (mínimo 2.0 y máximo 14.5 horas), sin NE subaracnoideo medible en las cirugías que duraron 4 horas o menos y del 44% al 50% en aquellas con tiempos quirúrgicos mayores a 6 horas.9 Con todo esto, la posición fue el predictor positivo más importante para la aparición de NE en el postoperatorio, seguido de la edad del paciente y el tiempo quirúrgico, así como el género masculino.
Prevalencia de neumoencéfalo, neumoencéfalo a tensión, patrones y grados
En este estudio, la prevalencia de NE postquirúrgico en patología de fosa posterior en PSS fue de 93.2%, mientras que en la literatura se ha reportado una prevalencia desde 42.1% al 100%, sin embargo, rara vez se hace sintomático.
En este estudio no se presentó ningún caso de NE a tensión, con una incidencia de 0-3.3% en la literatura; algo importante a resaltar es que la aparición de los síntomas del NE a tensión no depende de la cantidad exacta de aire intracraneal.3,5,8,9,13,21 El patrón más frecuente en esta serie fue el NE subdural, seguido de subaracnoideo, lo cual podría explicarse porque la mayoría de los pacientes tenían más de 40 años, en los cuales la atrofia cerebral incipiente puede ser causa de acumulación de aire en este espacio. Además, se ha descripto en la literatura que la apertura de las cisternas del ángulo pontocerebeloso predisponen para el NE subdural, y la apertura del cuarto ventrículo por cualquier vía predispone para el NE ventricular, que es el menos frecuente de los casos, como fue hallado en nuestro estudio.5
Neumoencéfalo y resultados neurológicos a los 30 días
Si bien la prevalencia de NE postquirúrgico en pacientes operados de patología de fosa posterior en PSS es alta (llegando a ser incluso del 100%), esta complicación no implica significativamente resultados neurológicos y funcionales. Esto, probablemente porque en la mayoría de los casos el NE no genera síndrome de hipertensión endocraneana (en este estudio no hubo casos de NE a tensión) y su resolución suele conseguirse con medidas no invasivas como oxígeno al 100% y cabecera a 30º. Sin embargo, se debe prestar atención a la evolución neurológica para detectar precozmente signos de NE a tensión, que puede provocar aumento de la PIC, hernia del tronco encefálico, coma y muerte.6,8,22-24
En el presente estudio, todos los casos de NE postquirúrgico fueron asintomáticos, y todos se resolvieron con las medidas conservadoras ya mencionadas. Sin embargo, es preciso conocer las opciones de descompresión neuroquirúrgicas señaladas, en caso de NE a tensión: descompresión con aguja, a ciegas o bajo guía radiológica a través de craneotomía,25 descompresión controlada con drenaje cerrado bajo sello de agua,26 ventriculostomía para NE ventricular y craniectomía descompresiva.23 La elección de la técnica de descompresión neuroquirúrgica depende de la experiencia del cirujano, el protocolo institucional y la disponibilidad de recursos.
CONCLUSIONES
La mayoría de los pacientes presentaron NE postquirúrgico. Este no tuvo implicancia clínica significativa en los pacientes (sin casos con NE a tensión). El patrón más frecuente fue el subdural. La edad es un posible factor de riesgo para presentar NE postquirúrgico. Un mayor tiempo quirúrgico es un posible factor de riesgo para el NE subdural; patología tumoral y apertura de cisternas basales medial o tanto medial como lateral son posibles factores de riesgo para NE ventricular.
LIMITACIONES
Este estudio tiene como limitaciones las propias de los estudios transversales. Las asociaciones encontradas en este estudio son estadísticas y no garantizan como tal una relación causa-efecto, se requiere de estudios analíticos para corroborar las hipótesis de asociación de este estudio.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
BIBLIOGRAFÍA