Astrocitoma pilocítico cerebeloso
Estudio de cohorte retrospectivo evaluando el resultado funcional postoperatorio, el mutismo y la hidrocefalia.
Ruella Mauro1, Giovannini Sebastian Juan Maria1, Pirozzi Chiusa Christian2, Pérez Zabala Joaquín2
1 Departamento de Neurocirugía. Fleni. Montañeses 2325, CP 1428 Buenos Aires. argentino
2 Departamento de Neurocirugía. Hospital de Pediatría Juan P. Garrahan, Buenos Aires. argentina
RESUMEN
Objetivo: Analizar una serie de pacientes pediátricos con APc evaluando factores que puedan modificar el desenlace en cuanto a “outcome” neurológico, mutismo e hidrocefalia.
Materiales y métodos: Estudio unicéntrico, de cohorte retrospectivo, de pacientes quirúrgicos con APc y al menos 12 meses de seguimiento. Se evaluaron factores clínicos, imagenológicos y quirúrgicos, histopatología y adyuvancia. El resultado clínico se categorizó mediante la FSS y Bloom-Scale a corto y largo plazo.
Resultados: Se incluyeron un total de 100 pacientes con un seguimiento medio de 53,9 meses, sin predileccion por sexo y con una edad media de 7,6 años. La localización más frecuente fue central y el 24% de los tumores presentó invasión troncoencefálica. 79 pacientes presentaban hidrocefalia al diagnóstico y 48% requirieron tratamiento preoperatorio. Se logró RT en el 67% de los casos. Se observó mutismo en 15 pacientes, asociado estadísticamente a la localización, la invasión pontina, el BSm preoperatorio y la meningitis/ventriculitis postoperatoria.
El “outcome” funcional se correlacionó con complicaciones como meningitis/ventriculitis y hematoma cerebeloso, mutismo y recurrencia. Se observó recurrencia en el 26% de los casos y la reintervención quirúrgica fue la terapéutica elegida.
Conclusión: El tratamiento de los APc en pacientes pediátricos se asocia a resultados relativamente favorables. La recidiva, el mutismo y las complicaciones quirúrgicas juegan un valor pronóstico en el desenlace y por lo tanto deben manejarse adecuadamente. Debe considerarse el tratamiento temprano con intención de RT, optando, de no ser posible, dejar un residuo tumoral por sobre el daño neurológico. El tratamiento de la hidrocefalia en instancia preoperatoria requiere un manejo individualizado.
Palabras llave: Astrocitoma pilocítico cerebeloso; Niños; Outcome del tratamiento; Mutismo; Hidrocefalia.
ABSTRACT
Objective: Analyze a series of pediatric patients with cPAs evaluating factors that may determine the final outcome in terms of neurological status, mutism and hydrocephalus.
Materials and methods: Single Center, retrospective study of a cohort of surgical patients with cPA and a minimum of 12 months follow-up. Clinical, imaging and surgical features, histopathology and adjuvancy were assessed. Patient´s clinical outcome was categorized using the FSS and Bloom-Scale at short and long term.
Results: A total of 100 patients with a mean follow-up of 53.9 months were included. 54% of the analyzed population was female and the mean age was 7.6 years. The most frequent location was central and 24% of tumors were associated with brainstem invasion. Hydrocephalus was present in 79 patients at diagnosis requiring preoperative treatment in 48% of cases. GTR was achieved in 67% of patients. Mutism was observed in 15 patients and statistically associated with location, pontine-invasion, preoperative Bloom-score and postoperative meningitis/ventriculitis.
Functional outcome correlated to complications such as meningitis/ventriculitis and cerebellar hematoma, mutism and recurrence.
Recurrence was seen in 26% of cases and reoperation was the therapeutic chosen followed by chemotherapy in almost half of patients.
Conclusion: The treatment of cPA in pediatric patients results in relatively favorable outcomes. Recurrence, mutism and surgical complications have shown significant prognostic value for outcome and should therefore be adequately managed. Early treatment with the intention of achieving GTR should be considered, accepting leaving residual tumor against neurologic harm on the contrary. Carefully tailored decisions should be taken when dealing with hydrocephalus at a prior instance.
Keywords: Cerebellar Pilocytic astrocytoma; Children; Treatment outcome; Mutism; Hydrocephalus.
ABREVIACIONES
APc: Astrocitoma pilocítico cerebeloso
FSS: Functional Status Scale
BSm: Bloom Scale modificada
SLP: Sobrevida libre de progresión
RT: Resección total
RCT: Resección casi total
RST: Resección subtotal
RMN: Resonancia magnética nuclear
TC: Tomografía computada
DVE: Derivación ventricular externa
TVE: Tercer ventriculostomía endoscópica
DVP: Derivación ventriculoperitoneal
INTRODUCCIÓN
Los astrocitomas pilocíticos pediátricos son uno de los tumores del SNC (Sistema Nervioso Central) más frecuentes en la infancia. Representan del 15 al 25 % de todos los tumores del SNC pediátricos y 25 al 35 % de los tumores de fosa posterior infantiles, con una incidencia máxima entre los 6 y los 8 años de edad, no habiendo predilección por sexo1. Corresponde a un tumor benigno que se clasifica como Grado I de la OMS 2. La resección quirúrgica completa es el objetivo del tratamiento de primera línea con buenos resultados a largo plazo1,3,4. La adyuvancia se basa principalmente en la quimioterapia y suele emplearse en caso de resección subtotal (RST) en tumores extensos, progresión y recurrencia1. Sin embargo, incluso en casos de RST, el pronóstico es favorable con estabilización e incluso regresión tumoral1,3,4. El resultado quirúrgico se puede analizar en un seguimiento corto en términos del grado de resección, complicaciones postoperatorias, mutismo y tratamiento de la hidrocefalia; y en largo plazo en función de los déficits neurológicos permanentes, los trastornos cognitivos, la calidad de vida, las tasas de supervivencia y la recurrencia, entre otros factores. El propósito de este estudio es analizar nuestra serie de pacientes pediátricos con APcs evaluando características demográficas, clínicas, de neuroimagen, histopatología, manejo y complicaciones que puedan modificar o determinar el resultado final en cuanto al estado neurológico, mutismo e hidrocefalia.
MATERIALES Y MÉTODOS
Estudio unicéntrico, retrospectivo analítico de una cohorte de pacientes quirúrgicos con diagnóstico de cPA intervenidos entre enero de 2008 y enero de 2021 en el Hospital Dr. Juan. P. Garrahan, Buenos Aires, Argentina. Se excluyeron pacientes con menos de 12 meses de seguimiento. Se analizaron características demográficas, clínicas, neuroimágenes, quirúrgicas, histopatología y adyuvancia. El resultado clínico final de los pacientes se categorizó utilizando la escala de Bloom modificada y las escalas FSS en la primera evaluación, antes del alta y última evaluación. La recurrencia, SLP y mortalidad también fueron analizadas. Las tablas 1 y 2 resumen las variables incluidas. Se revisó la literatura sobre esta entidad acorde al diagnóstico, presentación y manejo a fin de comparar otras series y resultados a largo plazo.
Protocolos de estudio y definiciones
Se incluyeron pacientes menores de 18 años.
Todos los pacientes fueron estudiados con resonancia magnética y tomografía computarizada cerebrales con contraste pre y postoperatorios. Aproximadamente el 80% de los pacientes también fueron estudiados con resonancia magnética espinal.
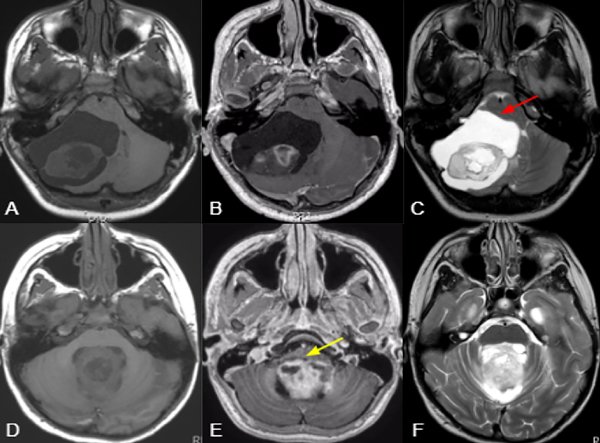
Los tumores centrales se definieron como aquellos emergiendo del vermis/paravermis o localizados en el IV ventrículo. Los tumores originados en un hemisferio cerebeloso con crecimiento medial y compresión del IV ventrículo no entran en esta categoría. (Figura 1)
Los tumores sólidos se categorizaron como lesiones cuyo componente sólido corresponde a más del 90% de su naturaleza. Se englobaron las lesiones quísticas independientemente de su presencia o ausencia de nódulo mural o componente sólido. (Figura 1,2)

Figura 1. Imágenes ilustrativas de RM ponderadas en T1 (A,D), T1+ gadolino (B,E) y T2 (C,F), comparando una lesión predominantemente hemisférica y quística con efecto de masa y desplazamiento troncal (flecha roja) (A;C), con otra central y sólida con invasión troncal (flecha amarilla) (D:F). En el primer caso es más factible lograr la RT y menor riesgo de requerimiento de manejo post operatorio de hidrocefalia o recurrencia, mientras que en el segundo presenta un mayor riesgo de RST, mutismo y necesidad de manejo postoperatorio de hidrocefalia o recurrencia.
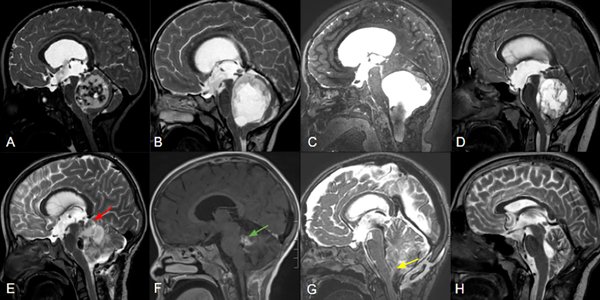
Figura 2. Cortes sagitales de RM de pacientes con APcs asociados a invasión troncoencefálica a distintos niveles: mesencefálica (A), pontina (B) y bulbar (C), con sus controles postoperatorios respectivos (E:G) señalando remanentes tumorales (flechas roja, verde y amarilla). La figura D demuestra una lesión predominantemente sólida y central que comprime pero no invade el tronco, la cual pudo ser completamente resecada (H).
El volumen se calculó midiendo los diámetros transversal, cefalocaudal y anteroposterior de la RM con contraste preoperatoria divididos por 2 [(A + B + C) ÷ 2].
El grado de resección se categorizó como resección total (RT), resección casi total (RCT), resección subtotal (RST) basada en la observación intraoperatoria del neurocirujano y RM con gadolinio postoperatoria analizada por especialistas en neuroimágenes (Figura 2). La RT correspondió a los casos en los que todos los hallazgos de imagen postoperatorios fueron negativos de acuerdo con la apreciación de los neurocirujanos. La RCT correspondió mayoritariamente a los casos en los que quedó un residuo tumoral mínimo < 2%, como en los casos de invasión del IV ventrículo, o cuando se consideró resección completa, pero aún se identificaron restos mínimos en la RM postoperatoria. RST, consecuentemente corresponde a cualquier resección que no alcanzaba los criterios anteriores.
La presentación clínica de todos los pacientes y el resultado postoperatorio mediato (15 días después de la cirugía aproximadamente) y tardío (última evaluación), fueron evaluados mediante la Escala de Bloom y el FSS (Functional Status Scale).
Las puntuaciones de la escala de Bloom4,5 se definieron de la siguiente manera: Grado 1 = sin discapacidad, Grado 2 = discapacidad leve pero con un estilo de vida activo, Grado 3 = discapacidad parcial con una capacidad reducida para cuidarse a sí mismo y Grado 4 = discapacidad grave con incapacidad para el autocuidado.
La puntuación FSS es una escala validada para diferentes edades pediátricas desarrollada por un proceso de consenso multidisciplinario en el que se evalúan seis dominios de funcionamiento que incluyen estado mental, sensorial, comunicación, motor, alimentación y respiratorio; con valores que van desde normal: 1 hasta disfunción muy grave: 5. El resultado final del examen va desde un valor mínimo de 6 hasta un máximo de 30, y se categoriza como: resultado bueno <=7, resultado moderado 8-15 y resultado malo >=16.6
La hidrocefalia se definió y calculó en base al índice de Evans. Se consideró normal un cociente < 0,3.
Análisis estadístico
Se asumió la distribución normal de los datos en base al Teorema del Límite Central. Las variables categóricas son presentadas como frecuencias absolutas y relativas, las variables continuas como media y desvío estándar. Para evaluar la relación entre las diferentes variables independientes y la variable resultado, la FSS tardía y postoperatoria, se utilizó un análisis de regresión lineal. Los supuestos se verificaron previo al análisis. <0,05 p se utilizó como valor de corte para la significancia. Para el análisis estadístico se empleó el programa R 4.1.2. Para evaluar las variables independientes categóricas, el advenimiento del mutismo y tratamiento de la hidrocefalia postoperatoria, se empleó una regresión logística. Se eligieron las variables dependientes que demostraron una correlación individual significativa con base en las pruebas de Pearson, Chi Square y Fisher. <0,05 se utilizó como valor de corte para la significancia. Las variables dependientes seleccionadas se emplearon en un análisis de regresión logística multivariado para demostrar la importancia general y determinar el OR.
RESULTADOS
Se incluyeron un total de 100 pacientes con un seguimiento medio de 53,9 meses (rango 12-156). El 54% de la población analizada era de sexo femenino y la edad media fue de 7,6 años. La localización más frecuente fue la central (64%), y 29% de los casos correspondió a lesiones sólidas. El 24% de los tumores se asoció con invasión del tronco encefálico o de los pedúnculos cerebelosos (Figura 2).
El síntoma inicial más frecuente fue la cefalea (75%), seguido de ataxia o alteración de la marcha (73%) y náuseas/vómitos (67%). La presentación clínica preoperatoria demostró una puntuación de Bloom media de 2,46 (0,57) y una FSS media de 7,28 (0,877). 79 pacientes presentaban hidrocefalia al diagnóstico y 48% requirieron tratamiento preoperatorio. Las principales características de la población analizada y los hallazgos imagenológicos se resumen en las Tablas 1 y 2.
Table 1. Resumen de las características de los pacientes y presentación clínica.
Categorías |
|
Total |
Edad a la cirugía |
|
|
Media (DS) |
|
7.63 (3.93) |
Mediana [Min, Max] |
|
7.00 [1.00, 18.0] |
Sexo |
|
|
Masculino |
|
46 (46.0%) |
Femenino |
|
54 (54.0%) |
Presentación clínica |
|
|
Incidental |
|
|
No |
|
96 (96.0%) |
Si |
|
4 (4.0%) |
Náusea/Vómitos |
|
|
No |
|
33 (33.0%) |
Si |
|
67 (67.0%) |
Cefalea |
|
|
No |
|
25 (25.0%) |
Si |
|
75 (75.0%) |
Ataxia |
|
|
No |
|
27 (27.0%) |
Si |
|
73 (73.0%) |
Rigidez de nuca/Cervicalgia |
|
|
No |
|
97 (97.0%) |
Si |
|
3 (3.0%) |
Mareos/Vértigo |
|
|
No |
|
82 (82.0%) |
Yes |
|
18 (18.0%) |
Síntomas visuales |
|
|
No |
|
65 (65.0%) |
Diplopia |
|
17 (17.0%) |
Visión borrosa |
|
18 (18.0%) |
Torticollis |
|
|
No |
|
94 (94.0%) |
Si |
|
6 (6.0%) |
Otros |
|
|
Ninguno |
|
87 (87.0%) |
Disartria |
|
3 (3.0%) |
Convulsiones |
|
2 (2.0%) |
Hemiparesia |
|
2 (2.0%) |
Tinnitus/Paresia facial |
|
3 (3.0%) |
Pérdida de conciencia |
|
3 (3.0%) |
Table 2. Resumen de hallazgos imagenológicos, manejo terapéutico y resultados quirúrgicos.
Categorías |
|
Total |
Topografía |
|
|
Central |
|
64 (64.0%) |
Eccentrico |
|
36 (36.0%) |
Sólido/Quístico |
|
|
Sólido |
|
29 (29.0%) |
Quístico |
|
71 (71.0%) |
Hidrocefalia |
|
|
No |
|
21 (21.0%) |
Si |
|
79 (79.0%) |
Realce con contraste |
|
|
No |
|
16 (16.0%) |
Si |
|
84 (84.0%) |
Diseminación |
|
|
No |
|
90 (90.0%) |
Si |
|
10 (10.0%) |
Compromiso tronco encefálico |
|
|
No |
|
37 (37.0%) |
Invasión |
|
|
Bulbar |
|
15 (15.0%) |
Pontina |
|
6 (6.0%) |
Mesencefálica |
|
3 (3.0%) |
Compression |
|
39 (39.0%) |
Diámetro Máx. |
|
|
Media (DS) |
|
4.78 (1.31) |
Mediana [Min, Max] |
|
5.05 [1.40, 7.60] |
Faltante |
|
22 (22.0%) |
Volumen |
|
|
Media (DS) |
|
47.0 (31.5) |
Mediana [Min, Max] |
|
43.3 [1.30, 144] |
Faltante |
|
22 (22.0%) |
Bloom score preoperatorio |
|
Media (DS) |
2.46 (0.576) |
Mediana [Min, Max] |
2.00 [1.00, 4.00] |
FSS preoperatorio |
|
Media (SD) |
7.28 (0.877) |
Mediana [Min, Max] |
7.00 [6.00, 11.0] |
Craniectomía/Craneotomía |
|
Suboccipital medial |
80 (80.0%) |
Paremediano |
16 (16.0%) |
Retrosigmoideo |
4 (4.0%) |
Abordaje |
|
Transcortical |
39 (39.0%) |
TVM |
14 (14.0%) |
Transvermiano |
46 (46.0%) |
SCIT |
1 (1.0%) |
Grado de resección |
|
RT |
67 (67.0%) |
RCT |
19 (19.0%) |
RST |
14 (14.0%) |
Complicaciones |
|
Ninguna |
79 (79.0%) |
Fístula/Pseudomeningocele |
7 (7.0%) |
Hematoma Subdural/Epidural |
5 (5.0%) |
Hematoma cerebeloso |
1 (1.0%) |
No Quirurgica |
8 (8.0%) |
Infecciones |
|
No |
85 (85.0%) |
SSI |
2 (2.0%) |
Meningitis/ventriculitis |
13 (13.0%) |
Abscess |
1 (1.0%) |
Tratamiento preoperatorio de hidrocefalia |
|
Ninguno |
62 (62.0%) |
DVE |
18 (18.0%) |
TVE |
14 (14.0%) |
Shunt VP/VA |
6 (6.0%) |
Tratamiento postoperatorio de hidrocefalia |
|
Ninguno |
63 (63.0%) |
DVE |
3 (3.0%) |
Shunt VP/VA |
20 (20.0%) |
TVE |
12 (12.0%) |
Ommaya |
2 (2.0%) |
Bloom Score postoperatorio |
|
Media (DS) |
2.51 (0.674) |
Mediana [Min, Max] |
2.00 [2.00, 4.00] |
FSS postoperatorio |
|
Media (DS) |
7.70 (1.67) |
Mediana [Min, Max] |
7.00 [6.00, 18.0] |
Bloom Score tardío |
|
Media (DS) |
1.53 (0.627) |
Mediana [Min, Max] |
1.00 [1.00, 4.00] |
FSS tardío |
|
Media (DS) |
6.33 (0.620) |
Mediana [Min, Max] |
6.00 [6.00, 9.00] |
Mutismo |
|
No |
85 (85.0%) |
Si |
15 (15.0%) |
Recurrencia/Progresión |
|
No |
74 (74.0%) |
Si |
26 (26.0%) |
Recirugia |
|
No |
74 (74.0%) |
Si |
26 (26.0%) |
Mortalidad |
|
No |
100 (100%) |
Follow up |
|
Media (DS) |
53.9 (36.6) |
Mediana [Min, Max] |
47.0 [12.0, 156] |
La RT se logró en el 67% de los casos. La craneotomía suboccipital medial se empleó en el 80 % y el abordaje transvermiano fue la vía más frecuentemente empleada en el 46 % de los casos.
Se observaron complicaciones postoperatorias en el 21% de los casos. Las infecciones fueron la complicación más frecuente (15%), de las cuales 13 se asociaron a meningitis. La segunda complicación en frecuencia correspondió a fístula de LCR/pseudomeningocele, observada en 7 pacientes, de los cuales uno requirió tratamiento quirúrgico. Se observó mutismo en el 15% de los pacientes. Las características quirúrgicas se resumen en la Tabla 2.
Se observó recurrencia o progresión tumoral en un 26 % de los casos. De estos pacientes, 6 tenían RT previa (8,9%). La reoperación fue el tratamiento elegido en todos los casos seguido de quimioterapia en 12 pacientes (46%). La radioterapia se empleó en el 5% de los pacientes. Como hallazgo a destacar, un paciente desarrolló 49 meses después de la última cirugía por recidiva tumoral y 7 meses post-radioterapia, un glioblastoma en la zona vecina (fusión BRAF negativa en comparación con la lesión previa).
No se reportaron muertes.
Análisis estadístico.
Se encontró asociación entre la puntuación de FSS tardía y la postoperatoria con un modelo explicativo del 69% de la varianza (R2 ajustado=0,69, p<0,05). Después del ajuste con el resto de las variables, el aumento de 1 unidad en el puntaje FSS postoperatorio se asoció con un aumento promedio de 0,23 unidades (IC 95%= 0,0064-0,44, p=0,04) en el puntaje tardío (Figura 3). Al analizar la FSS postoperatoria en un modelo de regresión lineal multivariado explicativo del 77% (R2 ajustado=0,77,9), se observaron diferentes factores asociados, como las complicaciones quirúrgicas. La presencia de hemorragia cerebelosa se asoció con un aumento de 6,3 unidades en la FSS postoperatoria (p= 0,0002; IC=3,27-9,45). La meningitis/ventriculitis determinó un aumento de 1,5 unidades (p=0,009; IC=0,41-2,6). Al mismo tiempo, el mutismo se asoció con un aumento de 1,97 unidades en la FSS postoperatoria (p=0,005, IC= 0,63-3,3) (Figura 4). Al analizar la recurrencia o progresión tumoral encontramos que esta misma, con necesidad de una segunda cirugía se asoció con un aumento de 2 unidades (p=0,006; IC=0,039-4,5). Ninguna de las otras variables analizadas mostró asociación en el análisis multivariado.
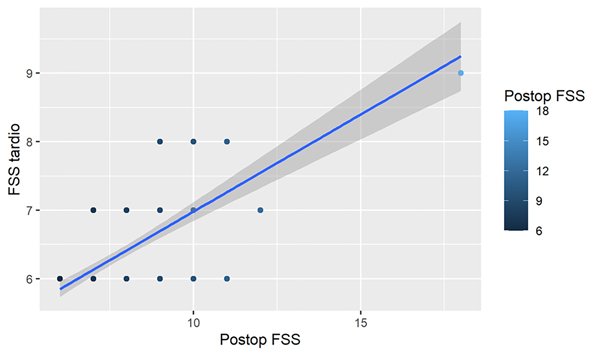
Figura 3. Relación lineal entre el FSS tardío y postoperatorio. El aumento de 1 unidad en el puntaje FSS postoperatorio se asoció con un aumento promedio de 0,23 unidades (IC 95%= 0,0064-0,44, p=0,04) en el puntaje tardío.
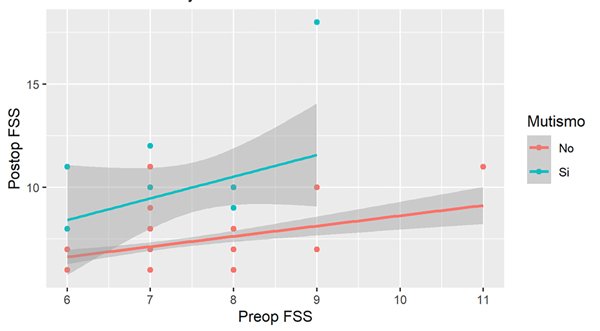
Figura 4. Impacto del mutismo en la relación entre el FSS pre y postoperatorio. El advenimiento de mutismo se asoció con un aumento de 1,97 unidades en la FSS postoperatoria (p=0,005, IC= 0,63-3,3)
En cuanto a la aparición del mutismo, se optó por un análisis de regresión logística multivariado con adecuada bondad de ajuste (AIC 74, desviación residual 56 y Nagelkerke pseudo R2 de 0,72).
Al analizarlas individualmente, las variables estadísticamente relacionadas con la presencia de mutismo fueron el Bloom-Score preoperatorio, la invasión pontina, la localización, la infección (meningitis/ventriculitis) y el tratamiento preoperatorio de hidrocefalia (requerimiento de DVE) (Tabla 3). Después de controlar en un modelo multivariado, la invasión pontina determinó un aumento de 8,5 veces en el riesgo de mutismo (OR 8,57, p = 0,001). La puntuación de Bloom preoperatoria se asoció con un aumento de 5,5 veces en el riesgo de mutismo (IC 1,59-2,53; p=0,01). La excentricidad demostró una reducción del 90% en el riesgo cuando estaba presente (IC 0,005-0,49, p=0,05). Solo el 0,2% de los tumores excéntricos desarrollaron mutismo frente al 23,4% de los tumores centrales. Con respecto a las complicaciones, la meningitis/ventriculitis determinó un OR de 6,5 lo que significa un aumento de 6,5 veces el riesgo de mutismo (p=0,02).
Para concluir, se analizó la necesidad de tratamiento postquirúrgico de la hidrocefalia en un modelo de regresión logística multivariado con una bondad de ajuste significativa (AIC 97, desviación residual 49 y Nagelkerke pseudo R2 de 0,76). Hubo diferentes variables relacionadas con este resultado. Para empezar, como era de esperar, la presencia inicial de hidrocefalia aumentó el riesgo de un tratamiento final en 3,3 veces (p=0,03). También se vio la necesidad de un tratamiento previo. De todas las alternativas, el requerimiento de DVE previa se asoció con un aumento de la necesidad de un tratamiento posterior en 9,2 veces (p=0,001).
Table 3. Resumen de las variables relacionadas con mutismo.
Característica |
No, N = 851 |
Si, N = 151 |
p-value2 |
Edad a la cirugía |
7.0 (4.8, 10.0) |
7.0 (5.0, 12.2) |
0.6 |
Sexo |
|
|
0.4 |
Masculino |
37 (44%) |
9 (56%) |
|
Femenin |
47 (56%) |
7 (44%) |
|
Bloom score preoperatorio |
|
|
0.004 |
1 |
1 (1.2%) |
0 (0%) |
|
2 |
52 (62%) |
3 (19%) |
|
3 |
29 (35%) |
12 (75%) |
|
4 |
2 (2.4%) |
1 (6.2%) |
|
FSS preoperatorio |
|
|
0.3 |
6 |
17 (20%) |
2 (12%) |
|
7 |
36 (43%) |
4 (25%) |
|
8 |
28 (33%) |
9 (56%) |
|
9 |
2 (2.4%) |
1 (6.2%) |
|
11 |
1 (1.2%) |
0 (0%) |
|
Topografía |
|
|
0.007 |
Central |
49 (58%) |
15 (94%) |
|
Eccentrico |
35 (42%) |
1 (6.2%) |
|
Sólido/Quístico |
|
|
0.2 |
Sólido |
22 (26%) |
7 (44%) |
|
Quístico |
62 (74%) |
9 (56%) |
|
Hidrocefalia |
64 (76%) |
15 (94%) |
0.2 |
Diseminación |
10 (12%) |
0 (0%) |
0.4 |
Compromiso troncoencefálico |
|
|
<0.001 |
No |
35 (42%) |
2 (12%) |
|
Invasión bulbar |
14 (17%) |
1 (6.2%) |
|
Invasión pontina |
1 (1.2%) |
5 (31%) |
|
Invasión mesencefálica |
3 (3.6%) |
0 (0%) |
|
Compresión |
31 (37%) |
8 (50%) |
|
Volumen |
45 (18, 65) |
36 (23, 44) |
0.3 |
Abordaje |
|
|
<0.001 |
Transcortical |
39 (46%) |
0 (0%) |
|
TVM |
12 (14%) |
2 (12%) |
|
Transvermiano |
33 (39%) |
13 (81%) |
|
SCIT |
0 (0%) |
1 (6.2%) |
|
Grado de resección |
|
|
0.2 |
RT |
59 (70%) |
8 (50%) |
|
RCT |
15 (18%) |
4 (25%) |
|
RST |
10 (12%) |
4 (25%) |
|
Tratamiento preoperatorio de hidrocefalia |
|
|
0.004 |
Ninguno |
57 (68%) |
5 (31%) |
|
DVE |
10 (12%) |
8 (50%) |
|
TVE |
12 (14%) |
2 (12%) |
|
Shunt |
5 (6.0%) |
1 (6.2%) |
|
Ki 67% |
|
|
0.4 |
<5% |
37 (51%) |
8 (62%) |
|
5-10$ |
18 (25%) |
4 (31%) |
|
>=10% |
18 (25%) |
1 (7.7%) |
|
Complicaciones |
|
|
0.004 |
Ninguna |
71 (85%) |
8 (50%) |
|
Fístula/Pseudomeningocele |
5 (6.0%) |
2 (12%) |
|
Hematoma subdural/epidural |
4 (4.8%) |
1 (6.2%) |
|
Hematoma cerebeloso |
0 (0%) |
1 (6.2%) |
|
No quirurgicas |
4 (4.8%) |
4 (25%) |
|
Infecciones |
|
|
0.004 |
No |
74 (88%) |
9 (56%) |
|
ISQ |
2 (2.4%) |
0 (0%) |
|
Meningitis/ventriculitis |
6 (8.3%) |
7 (44%) |
|
Abscess |
1 (1.2%) |
0 (0%) |
|
Bloom Score postoperatorio |
|
|
<0.001 |
2 |
57 (68%) |
1 (6.2%) |
|
3 |
23 (27%) |
11 (69%) |
|
4 |
4 (4.8%) |
4 (25%) |
|
FSS postoperatorio |
|
|
<0.001 |
6 |
16 (19%) |
0 (0%) |
|
7 |
44 (52%) |
0 (0%) |
|
8 |
16 (19%) |
1 (6.2%) |
|
9 |
5 (6.0%) |
8 (50%) |
|
10 |
1 (1.2%) |
4 (25%) |
|
11 |
2 (2.4%) |
1 (6.2%) |
|
12 |
0 (0%) |
1 (6.2%) |
|
18 |
0 (0%) |
1 (6.2%) |
|
Recurrencia/Progresión |
20 (24%) |
6 (38%) |
0.3 |
Recirugia |
20 (24%) |
6 (38%) |
0.2 |
1 Median (IQR); n (%) |
|||
La RST hizo que esta variable de resultado fuera un 6% más probable (p=0,007). Solo el 14% de los pacientes con RST no requirieron un tratamiento final para la hidrocefalia. Otro factor asociado fue la complicación hemorrágica, que demostró un aumento del riesgo de 1,69 (p=0,007) y la meningitis/ventriculitis con un aumento de 1,28 (p=0,05). El análisis univariado demostró relación con la invasión pontina, el abordaje transvermiano y el mutismo. Esto no se demostró en un modelo multivariado. Respecto a este último factor, el 63% de los pacientes que presentaron mutismo requirieron tratamiento postoperatorio de hidrocefalia.
DISCUSIÓN
El objetivo del manejo de los pacientes con Astrocitomas cerebelosos de bajo grado es la supervivencia a largo plazo con buena calidad de vida 4. Hay muchos factores que juegan un papel en el resultado neurológico final de los APcs. Aunque muchas investigaciones han abordado este concepto, son escasas las que evalúan cómo dichos parámetros pueden predecir los resultados en estos pacientes. En nuestro trabajo analizamos cómo las variables clínicas, imagenológicas y quirúrgicas preoperatorias pueden influir en el resultado clínico postoperatorio de los niños con APc tratados quirúrgicamente en nuestro centro. Nuestra serie evalúa tanto el riesgo de mutismo postoperatorio, el manejo de la hidrocefalia y el resultado neurológico en APc exclusivamente, medido este último por una escala no utilizada antes en este tema (FSS) que corresponde a una cuantitativa, rápida y fiable valoración con mínima dependencia de evaluaciones subjetivas para la medida de resultado6.
La presentación clínica de los APc está dada principalmente por la localización en fosa posterior y por el aumento de la presión intracraneal (PIC) secundario a la hidrocefalia1. Los síntomas pueden tener un inicio insidioso según la capacidad del cerebro pediátrico para compensar y el desconocimiento de los síntomas 1. La cefalea es el síntoma de presentación más frecuente en nuestra serie (Tabla 1), seguida de los vómitos. También se observan con frecuencia papiledema y diplopía 1. Otros síntomas localizados en el cerebelo son la ataxia, el nistagmo y la alteración de la marcha, que pueden ser difíciles de identificar en pacientes pediátricos. En ocasiones, la rigidez de nuca o la tortícolis pueden ser el único signo de presentación de un tumor de fosa posterior, especialmente en aquellos que se extienden caudalmente al IV ventrículo, típico de los ependimomas1,7. En nuestra serie el 9% de los casos presentaba tortícolis o rigidez de nuca en el momento de la presentación clínica.
La resonancia magnética con gadolinio es el estándar de oro para el diagnóstico e ilustra las características sólido-quísticas del tumor, la extensión, la diseminación leptomeníngea y la relación con las estructuras circundantes así como también la hidrocefalia 1. La apariencia clásica es una masa quística, con un componente sólido que realza en forma excéntrica y sin restricción en la secuencia DWI. La pared del quiste puede comprender solo tejido cerebeloso gliótico o puede contener tejido tumoral. El patrón de realce de la RM puede ser útil para distinguir ambos casos 1. Otros APc son quísticos, sin un nódulo mural evidenciable, mientras que algunos son principalmente sólidos 1 (Figuras 1,2). Como se mencionó anteriormente en nuestro trabajo no discriminamos tumores quísticos con o sin nódulo mural. La literatura define la gran mayoría de los tumores sólidos como de línea media y por lo tanto más difíciles de distinguir imagenologicamente de meduloblastomas o ependimomas (90 %)1,8. En nuestro estudio este hecho se observó en casi el 70% de los pacientes. Las características sólido-quísticas del tumor no se han relacionado con el resultado quirúrgico, como se demuestra en nuestro análisis. La localización tampoco afectó el resultado, en comparación con otros reportes 9, a pesar de estar relacionado con la aparición del mutismo.
La resección completa sigue siendo el pilar del tratamiento y el principal factor pronóstico en la SLP o recurrencia1,3,10. Cuando se documenta RT en la RMN postoperatoria, no hay necesidad de tratamiento adicional y la tasa de supervivencia general a los 10 años es mayor al 90 %1,9. Sin embargo, las tasas reportadas de RT oscilan entre el 50 y el 89 %, siendo la causa más significativa de RST la invasión del tronco encefálico1,3,4. En nuestra serie, reportamos una tasa de RT del 67% comprobada no solo por la técnica micro neuroquirúrgica, sino también por RMN postoperatoria, lo que reduce las falsas consideraciones. El 96 % de los pacientes que no alcanzaron la resección completa tenían afectación del tronco encefálico, demostrando el 24 % de los tumores invasión del tronco encefálico o de los pedúnculos cerebelosos, en correlación con los resultados de la resección incompleta (Figura 2).
Al observar tumor residual en la imagen postoperatoria que pasó inadvertido en el intraoperatorio, se recomienda, de ser posible, una reintervención inmediata. 1,11. En caso contrario, el tratamiento es controversial debido al comportamiento indolente y resulta prudente dejar porciones del tumor invadiendo estructuras vitales en lugar de arriesgar déficits neurológicos permanentes3,4,11. Se recomienda en estos casos un seguimiento estricto clínico e imagenológico para identificar la progresión tumoral 1,11. Diversos estudios informan una SLP a 5 años de 45 a 65 % para tumor residual de cualquier tamaño y estabilidad a largo plazo o regresión del tumor residual en 33 a 65 %1.3.4.
Cuando se identifica progresión o recurrencia tumoral, se debe jerarquizar el tratamiento quirúrgico1,11. Si ese escenario no es posible, o para futuras recurrencias, debe evaluarse la terapéutica adyuvante. La quimioterapia se ha convertido en la terapia adyuvante inicial 1. La radioterapia generalmente se evita en el manejo inicial, especialmente en los primeros años de vida, debido a los efectos neurocognitivos adversos junto con el riesgo de transformación maligna (como se vio en uno de nuestros casos), sin evidencia clara de aumento de la supervivencia global1,11.
Se observó recurrencia o progresión tumoral en el 26% de nuestros casos con una correlación con el grado de resección (p = 0,0001). De estos pacientes, 6 tenían RT previa (8,9% de RT) vs 47% de RCT y 71% de RST, lo que respalda a la resección completa como factor pronóstico en este término, a pesar de las tasas más altas en comparación con otras series. El tiempo medio hasta la recurrencia fue de 33 meses (rango 6-92 meses). No hubo una correlación estadística entre el tiempo de recurrencia y el grado de resección, sin embargo, hubo una tendencia a recurrencias posteriores en RT y RCT, como se demostró en el trabajo de Ogiwara's3,10. La reintervención quirúrgica fue el tratamiento elegido en todos los casos seguida de quimioterapia en 12 pacientes (46%) con un control favorable de la enfermedad. La SLP desde el último control tumoral fue de 6 a 156 meses con una media de 45 meses.
Los patrones patológicos como el pleomorfismo y la mitosis pueden diferir sin embargo, generalmente no afectan el pronóstico12. Se encuentra en discusión la influencia de las características morfológicas asociadas a un mal resultado, como la atipia nuclear, la presencia mayor al 25 % de morfología oligodendroglial y la invasión leptomeníngea1. En nuestra serie, ni la diseminación leptomeníngea ni los valores de Ki-67% mostraron evolución desfavorable o riesgo de mutismo ni hidrocefalia.
Estudios han identificado el gen de fusión KIAA1549:BRAF en la mayoría de los casos. Un número menor de tumores tiene una mutación puntual BRAF o fusiones BRAF-RAF alternativas. Esta mutación se asocia con una mayor actividad transcripcional y proliferación celular. Sin embargo, los resultados no parecen verse afectados por la ausencia o presencia de esta alteración1,13. En nuestra serie únicamente el 58% de los pacientes fueron estudiados con este gen de fusión, correspondiendo a los casos más recientes. Un caso demostró desarrollo postoperatorio y radioterápico de glioblastoma en la zona vecina a un APc previo, con pérdida de esta fusión.
El frecuente debut de la hidrocefalia en los APcs obliga a considerar el tratamiento prequirúrgico, intraoperatorio o incluso postquirúrgico1. Puede resolverse mediante la exéresis quirúrgica14, especialmente en tumores con gran componente quístico y diferir su tratamiento a un segundo tiempo si es necesario. En otros casos, el aumento urgente de la PIC exige un manejo previo cuando la resección no es factible. La colocación de un DVE, la derivación ventrículo peritoneal o la tercer ventriculostomía endoscópica (TVE) son diferentes alternativas descriptas1,15,16. La decisión depende del protocolo de la institución y de la iniciativa del cirujano. Algunas series consideran la colocación de DVE en cada paciente para el drenaje intraoperatorio de LCR1,3, otras son más selectivas y otras declaran la exéresis tumoral como tratamiento definitivo sin necesidad de dos operaciones14. En nuestra serie, el 79% presentó hidrocefalia en el cuadro clínico inicial. De esa población, el 48% de los pacientes fueron tratados antes de la exéresis tumoral. La DVE correspondió al 47% de los tratamientos empleados (18 pacientes). Solo hubo 6 DVPs previas. La TVE fue elegida en el 36,8% de los casos (14 pacientes) con predilección por su elección en los últimos años, asociado a la progresiva experiencia en cirugía endoscópica (Tabla 2 y Figura 5). Cuando se realiza, garantiza el control de la PIC, evita la necesidad de un procedimiento de emergencia, reduce la incidencia de hidrocefalia postoperatoria y permite la relajación del cerebelo proporcionando un mejor escenario para la exéresis tumoral programada17. Además, evita la necesidad de una derivación protésica y la significativa cantidad de complicaciones potenciales que conlleva, lo que respalda su papel como terapia profiláctica para muchos autores17. El 72% de nuestros pacientes tratados previamente con TVE no requirieron procedimientos posteriores, y los que lo hicieron, la DVP fue el tratamiento elegido en el 14% de los casos seguido de una segunda TVE en el 8%. Sin embargo, hay estudios que indican que la incidencia reducida de colocación de derivaciones ventrículo peritoneales no justifican la TVE prequirúrgica, eligiéndola en subgrupos de niños con una alta incidencia de hidrocefalia persistente después de la cirugía tumoral (por ejemplo, meduloblastomas y ependimomas) y en pacientes en los que se debe diferir el tratamiento definitivo14-17. El reconocimiento de los factores que pueden predecir la persistencia de la hidrocefalia postoperatoria es esencial para el cirujano durante el asesoramiento del paciente y la planificación quirúrgica y también para continuar la modalidad del seguimiento clínico e imagenológico postoperatorio16.
Se requirió tratamiento de hidrocefalia postoperatoria en el 37% de los casos. Se desconoce la modalidad óptima de tratamiento18. Algunos estudios apoyan la TVE considerando la fisiopatología, las complicaciones y la durabilidad14,18. El tratamiento de elección fue la DVP (54%), seguida de la TVE (32,4%). En el 38 % (30/79) de los pacientes que presentaban hidrocefalia, esta fue resuelta mediante exéresis tumoral.
La presencia inicial de hidrocefalia aumentó el riesgo de un tratamiento final en 3,3 veces (p=0,03). Solo el 10% de los pacientes que no presentaban hidrocefalia en el cuadro clínico inicial requirieron un procedimiento final vs el 45% de los pacientes que sí la presentaron. El 23% de los pacientes que no requirieron un tratamiento previo, sí necesitaron un procedimiento para el manejo posterior de la hidrocefalia. De todas las alternativas elegidas en este escenario, el DVE reveló un aumento en la necesidad de un tratamiento posterior en 9,2 veces (p=0,001). El 78% de los pacientes manejados de esta manera requirieron un procedimiento final, en comparación con el trabajo de Gopalakrishnan et.al16. Finalmente, la RST y las complicaciones quirúrgicas como hemorragia y meningitis/ventriculitis también demostraron un aumento del riesgo. La invasión pontina, el abordaje transvermiano y el mutismo demostraron una relación estadísticamente significativa, sin embargo, esto no se mostró en el análisis multivariado. No encontramos diferencia en la necesidad de derivación ventrículo peritoneal postoperatoria en función de la localización del tumor en comparación con el trabajo de Gopalakrishnan16.
La Figura 5 resume el manejo de la hidrocefalia.
El mutismo cerebeloso generalmente incluye ataxia, hipotonía e irritabilidad con características específicas, como el inicio tardío, duración limitada relacionada con la gravedad inicial y recuperación espontánea asociada con disartria19-22. El vermis ha sido considerado inicialmente responsable de la iniciación del habla. Así, algunos autores relacionaron el abordaje transvermiano con el mutismo cerebeloso, pero la hipótesis no fue confirmada19 y tampoco hubo correlación con el abordaje quirúrgico en nuestro estudio. Otros trabajos atribuyen aspectos cognitivos del lenguaje al hemicerebelo cruzado derecho y proponen la diasquisis postoperatoria de la vía dento-rubro-tálamo-cortical como un componente fisiopatológico fundamental subyacente.19-23.
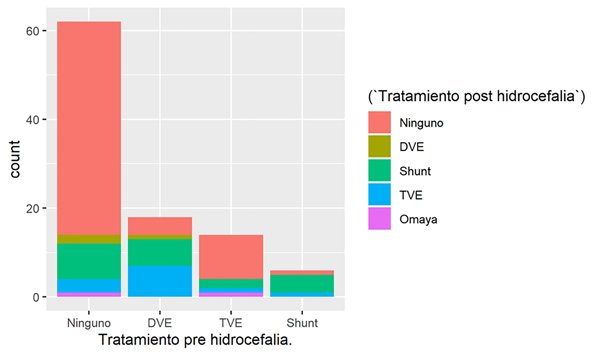
Figura 5. Resumen de las terapéuticas pre y postoperatorias en el manejo de hidrocefalia
La invasión del tronco encefálico y el diagnóstico histológico de meduloblastoma, junto con la localización en línea media, parecen representar las características más relevantes relacionadas con el desarrollo del mutismo 19:23. Las tasas van hasta un tercio de los casos1,2,3,11,19,20. En nuestro análisis, exclusivamente para APcs, se observó mutismo en el 15% de los pacientes. Los factores que demostraron correlación fueron la invasión pontina, el Bloom-score preoperatorio y la meningitis/ventriculitis postoperatoria. En cuanto al patrón de invasión, sería más específico el compromiso del cuarto superior del suelo del IV ventrículo, sugiriendo una disrupción de la vía eferente proximal del cerebelo 19,22. Como forma de discriminar y detallar este análisis, decidimos dividir la afectación del tronco encefálico en invasión bulbar, pontina y mesencefálica, siendo la segunda la variable significativa de acuerdo con esta premisa.
No hubo asociación con el volumen tumoral, las características sólido quísticas, el grado de resección ni con la presencia de hidrocefalia, en comparación con otros trabajos 19,21. Sin embargo, con respecto a esta última variable, hay informes que sugieren un mayor riesgo de hidrocefalia persistente en pacientes con mutismo, como se ve en nuestra serie.
El seguimiento mediante RM postoperatoria en pacientes con RT es controversial, se asocia con un costo económico adicional y generalmente se realiza con anestesia en pediatría 10, pero considerando los casos reportados de recurrencia, se recomienda 10 años como un período de seguimiento razonable1,3,11. En los casos de RST se recomienda un seguimiento más frecuente, a menos que el tumor retroceda por completo1.
La mortalidad global es muy baja con tasas del 0 al 4 % en grandes series1,3,11. No hubo óbitos en nuestra serie.
Teniendo en cuenta la sobrevida global, los resultados funcionales a largo plazo son relevantes. Se han descripto déficits neurológicos permanentes, así como trastornos cognitivos y psicológicos postquirúrgicos de APcs, que oscilan entre el 15 % a más del 50 %3,9,11,24. La mayoría de estas secuelas dan como resultado disfunción cerebelosa leve que incluyen lentitud motriz, dificultad para escribir, defectos en las habilidades manuales finas, dificultad en el equilibrio y el habla, así como déficits cognitivos que no impiden la educación superior y el funcionamiento independiente.1,3,9,11,24. Hemos observado las mismas secuelas en nuestro estudio. En el escenario postoperatorio, el Bloom-Score medio fue de 2,5 y el FSS de 7,7 (rango 6-18). El 60% de los pacientes tuvo un buen resultado, el 39% moderado y solo 1 caso un mal resultado (Figura 6). Las variables que presentaron asociación con un aumento del FSS postoperatorio fueron las complicaciones quirúrgicas como la hemorragia (caso en el que se observó el mayor FSS) y meningitis/ventriculitis. Al mismo tiempo, la aparición del mutismo y la recurrencia con necesidad de una segunda cirugía se asociaron a un aumento de este resultado final. Ninguna de las otras variables analizadas mostró asociación en el análisis multivariado.
El cuadro clínico final en el último seguimiento demostró una puntuación de Bloom media de 1,53 y un FSS medio de 6,33 (rango de 6 a 9). En esta etapa el 94 % obtuvo un resultado bueno y el 6 % un resultado moderado (Figura 6). Para pacientes con resultados desfavorables postoperatorios, la rehabilitación temprana, agresiva e integral contribuye significativamente a mejorar el resultado tardío del tratamiento y la calidad de vida de los pacientes 9.
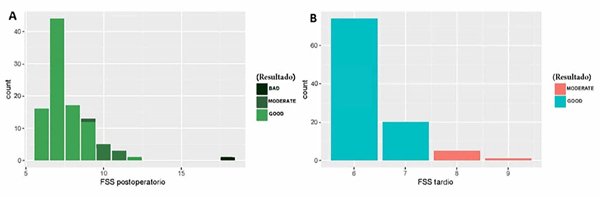
Figura 6. Distribución de los resultados de FSS tarios y postoperatorios categorizados. En el escenario postoperatorio (A) la media del FSS fue 7.7 (rango 6-18). 60% de los pacientes presentaron un buen resultado, 39% moderado y solo 1 caso un mal resultado. La imagen clínica final a largo plazo (B) demostró una media de FSS de 6.33 (rango 6-9). En esta instancia, el 94% de los pacientes presentó un resultado favorable y un 6 % moderado.
CONCLUSIÓN
El tratamiento de los APc en pacientes pediátricos se asocia a resultados funcionales relativamente favorables. La recidiva, el mutismo y las complicaciones quirúrgicas juegan un valor pronóstico en el desenlace y por lo tanto deben manejarse adecuadamente. Debe considerarse el tratamiento temprano con intención de RT, optando, de no ser posible, dejar un residuo tumoral por sobre el daño neurológico. El tratamiento de la hidrocefalia en instancia preoperatoria requiere un manejo individualizado.
LIMITACIONES
Reconocemos las limitaciones de nuestros hallazgos dada la naturaleza retrospectiva del diseño del estudio y por lo tanto sujeto a sesgos. Aunque el departamento de neurocirugía de esta institución toma decisiones consensuadas sobre el manejo de estas lesiones, el factor humano difiere y puede influir en los resultados. La definición de FSS tardío puede diferir entre los seguimientos (12 a 156), sin embargo, los déficits neurológicos no permanentes relevantes son factibles de resolver en el plazo de 1 año, tal como se muestra en nuestros resultados. El impacto cognitivo y psicológico en la calidad de vida no se ha evaluado directamente.
REFERENCIAS