Guia para la resección de gliomas de bajo grado en relación a áreas elocuentes en el paciente despierto con mapeo cortical y subcortical
Díaz Agustín Ignacio, Gallardo Federico, Orellana Marcelo, Chiarullo Marcos, Álvarez Caicedo Diana Carolina, Núñez Maximiliano
Hospital de alta complejidad en red “El Cruce” Néstor Kirchner - Florencio Varela, Buenos Aires, Argentina
Agustin Ignacio Diaz
agustin_diaz20@hotmail.com
Los autores declaran no tener conflictos de interés.
Recibido: julio de 2021. Aceptado: julio de 2021.
RESUMEN
Introducción: Los gliomas de bajo grado (I y II según la clasificación de la Organización Mundial de la Salud) son tumores de crecimiento lento y progresivo que afectan generalmente a pacientes jóvenes, quienes desarrollan una vida social y profesional normales, de manera asintomática u oligosintomática, o hasta que debutan con crisis comiciales. Inevitablemente se transformarán en lesiones con mayor grado de anaplasia, por lo que se consideran hoy en día una entidad premaligna. Está bien documentada la evidencia de que la extensión de resección de dicha entidad se correlaciona directamente con el tiempo de sobrevida y periodo libre de enfermedad. Paralelamente, el desarrollo del mapeo cortical mediante estimulación intraquirúrgica con el paciente despierto ha permitido la resección de este tipo de lesiones en aquellos casos en relación con áreas elocuentes, de acuerdo con limites funcionales (y no solamente anatómicos), facilitando resecciones más extensas y con importante disminución de déficits neurológicos permanentes.
El auge de la técnica, y por consiguiente interés en llevarla a cabo en cada vez un mayor número de instituciones, plantea un desafío debido a la coordinación multidisciplinaria necesaria entre un numeroso grupo de profesionales de la salud. Por lo tanto, resulta de vital importancia el desarrollo de una guía detallada, protocolizando dicha técnica, para ejecutarla con el mayor grado de eficiencia posible, ofreciendo así una mayor probabilidad de resultados exitosos.
El objetivo del presente trabajo es establecer un protocolo guía para la resección de glioma de bajo grado adyacentes a áreas elocuentes bajo mapeo cortical con paciente despierto durante el procedimiento quirúrgico, así como una revisión de sus indicaciones y contraindicaciones.
Métodos: Se realizó un estudio descriptivo en relación con el protocolo y metodología utilizada en la resección de gliomas adyacentes a áreas elocuentes bajo mapeo cortical y subcortical con paciente despierto durante el procedimiento quirúrgico.
A su vez, se utilizó material fotográfico y videos obtenidos en cirugías con pacientes despiertos en nuestro centro con el fin de ilustrar los pasos clave en la planeación y ejecución de esta técnica, así como una revisión bibliográfica.
Resultados: El protocolo y metodología utilizada en relación con la cirugía de glioma de bajo grado en relación con áreas elocuentes con el paciente despierto y mapeo cerebral fue pasible de una caracterización detallada. A través del mismo, se logró llevar a cabo una correcta coordinación entre las distintas tareas de los profesionales participantes, con adecuada fluidez entre las mismas. No se observaron dificultades en relación a obstáculos en la comunicación con el paciente durante el procedimiento o interrupciones en las labores de cada profesional.
Conclusión: Se planteó un protocolo o guía de pasos a seguir durante la realización de un procedimiento neuroquirúrgico específico con el paciente despierto, desde el proceso de selección prequirúrgica hasta la etapa de cuidados postquirúrgicos, el cual creemos que facilitará la compleja interacción entre los múltiples profesionales que implica, con la consiguiente mejoría en la eficacia y éxito del procedimiento.
Palabras Clave: “Gliomas de bajo grado”; “Mapeo cerebral cortical”; “Área elocuente”; “Neurocirugía con paciente despierto”.
ABSTRACT
Introduction: Low grade gliomas (WHO grade I-II) are progressive slow-growing tumors, that generally affect young adults, with a typically asymptomatic or oligosymptomatic course when diagnosed, except for debuting seizures, who enjoy normal social and professional lives so far.
It is well documented that these tumors will invariantly become anaplastic with time, which is why they are currently considered as a premalignant entity. In addition to this, it is also thoroughly reported how the extension of resection of these tumors is directly correlated with the overall and disease-free survival.
Concurrently, the development of intraoperative functional electrostimulation brain mapping during the “awake-sleep-awake” protocol of anesthesia, allowed the resection of these lesions in those cases in relationship to eloquent areas, based on functional boundaries, and not entirely on oncological or anatomical limits, optimizing the extension, and therefore aim for more total and supratotal resections, with substantial decrease in permanent neurological deficits.
The objective of the present study is to establish guidelines for awake craniotomy comprising low-grade gliomas near eloquent areas under cortical and subcortical brain mapping. We also reviewed its indications and contraindications.
Methods: We carried out a descriptive study about the protocol and methodology utilized in the resection of low-grade glioma adjacent to eloquent areas, under cortical and subcortical brain mapping with awake patient during the surgical procedure.
We also made use of photos and videos obtained in the course of awake craniotomies at our center in order to illustrate the key steps in planning and carrying out this procedure, as well as a bibliographic review.
Results: We were able to make a thorough characterization of the protocol and methodology utilized in the resection of low-grade glioma adjacent to eloquent areas, under cortical and subcortical brain mapping with awake patient during the surgical procedure. We were also capable of carrying out a meticulous coordination amongst the various professional’s labors throughout it, with appropriate fluidity. Difficulties concerning any kind of obstacles during the communication with the patient throughout the procedure or interferences on each of the professional’s labors were not observed.
Conclusion: A protocol or guidelines for awake craniotomies under cortical and subcortical brain mapping was proposed, for resection of low-grade gliomas with involvement of eloquent areas, including stages such as patient selection and post-operative care. We believe that it will facilitate the complex interaction between the several professionals involved in it, and the consequent improvement of the procedure’s effectiveness and success.
Key Words: “Low-grade glioma”; “Cortical brain mapping”; “Eloquent area”; “Awake neurosurgery”.
INTRODUCCIÓN
Los gliomas son neoplasias del sistema nervioso central (SNC), que se clasifican de acuerdo con la estirpe celular de la cual se originan y/o de ciertas características moleculares, conforme a la actualización de la OMS de 2016 sobre la clasificación de gliomas; y cuyo grado que se les otorga se correlaciona con su agresividad biológica, siendo el grado IV el de mayor malignidad.1
Los mismos dan cuenta de un 40-45% de la totalidad de los tumores primarios del SNC, entre los cuales los astrocitomas representan un 75% de los mismos, mientras que los ependimomas, oligodendrogliomas y otros subtipos de gliomas comprenden el 25% restante.1
Estos últimos generalmente afectan a adultos jóvenes entre la segunda y cuarta décadas de vida, siendo la convulsión el síntoma de presentación más frecuente en un 72-89%,2-5 motivando así la consulta con el especialista en la mayoría de los casos.4,6 Además pueden presentar cambios en el estado neurocognitivo en un 3-30% al momento de diagnóstico, así como síntomas secundarios a hipertensión endocraneana tales como cefalea y/o nauseas en un 10-44%,3,4 o déficit focal neurológico en un 10-30%.3 Sin embargo, un número considerable de pacientes pueden presentarse como hallazgo incidental, por demás asintomáticos.
Los gliomas de bajo grado se caracterizan por ser tumores de crecimiento lento pero progresivo, cuyas células tumorales migran a través y afectan los tractos de sustancia blanca. Invariablemente con el tiempo se transforman en lesiones anaplásicas o transformación maligna,7 motivo por el cual deben ser considerados como una entidad premaligna. Estos tumores evidencian un crecimiento constante de alrededor de 4 mm/año durante la fase premaligna en estudios seriados por RMN.8 Un aumento en dicho ratio de crecimiento permite identificar aquellos pacientes cuyos tumores poseen mayor riesgo de degeneración maligna.9 De manera interesante, se localizan más comúnmente en adyacencias o directamente involucrando áreas cerebrales elocuentes que participan en el desarrollo de funciones motoras, visuoespaciales o de la memoria, entre otras.10
Por todo lo antedicho, el manejo terapéutico de los gliomas de bajo grado plantea un desafío de alta complejidad en la actualidad debido a su tendencia a invadir el parénquima cerebral y su recurrencia tras el tratamiento inicial. Cuando los mismos se encuentran en relación con algún área elocuente plantean un nuevo desafío: el de lograr una máxima resección, sin agregar morbilidad.
El mapeo cerebral de las funciones del lenguaje y sensitivo-motoras, entre otras, mediante estimulación intraquirúrgica con el paciente despierto surgió como una respuesta a esta problemática y constituye el gold estándar para los tumores en dicha localización.11
A través de la historia, la craneotomía con el paciente vigil se ha utilizado para numerosas indicaciones con el objetivo de mejorar la seguridad en términos de morbilidad.12 Originalmente descripta por Horsley, popularizada por Penfield y llevada a cabo en la era moderna por otros, se han descripto diferentes técnicas y metodologías en la literatura para el testeo e identificación de áreas funcionales.13-15 En términos generales, se basa en el principio de que la estimulación de un área cortical o subcortical específica remeda una lesión focal pero transitoria para evaluar si dicha región, involucrada por tumor, es todavía esencial para la función (lo cual se observa en 15-20% de los casos).16,17 La estimulación de un área funcional inducirá una interrupción transitoria de la tarea a realizar por el paciente despierto durante la cirugía, guiado por un neuropsicólogo. De esta manera, se obtiene una correlación entre la topografía cerebral y las distintas funciones asociadas, o su ausencia en caso de no ser elocuentes, trazando así un mapeo cerebral a partir del cual se establecerá y guiará la resección ulterior del tumor.
Para tal fin es inherente el trabajo de distintos especialistas en el quirófano, donde pueden llegar a participar activamente alrededor de 10 profesionales o incluso más, y durante el postoperatorio en terapia intensiva y sala de cuidados intermedios.
Al tratarse de un equipo multidisciplinar que requerirá trabajar coordinadamente durante la cirugía nos propusimos desarrollar un protocolo con la finalidad de propagar la técnica y hacerla más asequible.
MATERIALES Y MÉTODOS
El equipamiento quirúrgico
Con respecto al equipamiento de neurofisiología utilizado en las intervenciones mencionadas en el presente estudio se utilizó:
El equipo multidisciplinar
Las intervenciones con el paciente despierto requieren un importante trabajo prequirúrgico y postquirúrgico. Para ello es imprescindible un equipo multidisciplinar y coordinado, con formación en neurociencias, ya que cada uno de ellos realizará una actividad específica y sin la cual no se podría llevar a cabo el procedimiento con eficacia.
Las especialidades relacionadas con dicho procedimiento comprenden:
El estudio analítico
Se realizó un estudio sobre la bibliografía relacionada a la neurocirugía con el paciente despierto, además del mapeo cortical y/o subcortical, utilizando como motor de búsqueda Pubmed siendo la base de datos Medline, empleando como palabras clave: “awake surgery”, “awake craniotomy”, “glioma surgery” y “brain mapping”.
Además, se ilustró la metodología aplicada en el desarrollo de la presente guía, mediante la ejemplificación de una serie de casos resueltos en nuestra institución, en conjunto con material fotográfico intraoperatorio obtenido durante los mismos.
RESULTADOS
Protocolo de cirugía con paciente despierto
Elección de paciente
En la actualidad, una de las indicaciones de la cirugía con el paciente despierto más empleadas es la neurooncológica. Su criterio primordial será en relación con la localización del tumor, en adyacencias a áreas elocuentes, en los cuales sea esperable o posible un deterioro en alguna función neurológica postquirúrgica, y cuya topografía cerebral relacionada pueda ser monitorizada durante la cirugía.
Por otra parte, se evaluarán posibles contraindicaciones, ya que no todo paciente apto para una intervención neuroquirúrgica es idóneo para una cirugía despierto:
Evaluación multidisciplinaria
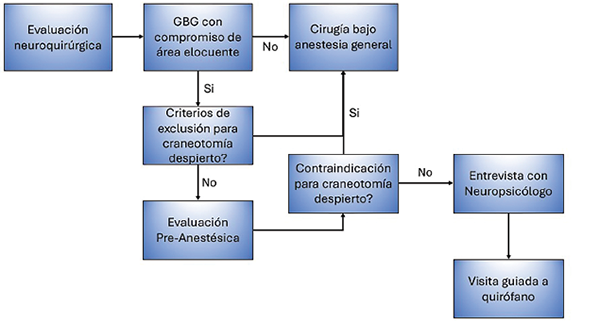
En primer término, resulta imperativa la preparación prequirúrgica adecuada. La misma incluye una evaluación multidisciplinaria a través de una serie de entrevistas llevadas a cabo por los especialistas involucrados en la cirugía (neurocirujano, neuropsicólogo y anestesista), en las cuales se informará en forma detallada y completa al paciente una descripción objetiva del procedimiento, los malestares esperados, las actividades a realizar durante el mismo y la posibilidad de complicaciones intraquirúrgicas y postquirúrgicas (Figura 1).

Figura 1. Diagrama de flujo durante la etapa prequirúrgica. GBG, Glioma de bajo grado.
Valoración neuroquirúrgica
Se debe efectuar previamente un examen neurocognitivo en forma sistemática para detectar déficits que no se hayan descubierto durante un examen físico neurológico estándar, incluyendo, según la localización del tumor, la evaluación de la orientación, lenguaje, praxia, memoria, cálculo, entre otras, así como establecer la dominancia o lateralidad del paciente (se puede utilizar el inventario de Edimburgo).24 Debe tenerse presente que se deben utilizar los mismos métodos de evaluación durante el procedimiento quirúrgico para tener una línea de base con la cual realizar la comparación de resultados, así como también adaptar la estrategia quirúrgica a los resultados descubiertos (mapeo funcional).22
Por otro lado, se pueden identificar algunos factores clínicos conocidos por tener valor predictivo en relación con la morbimortalidad asociada a la evolución de la patología.9,25,26 Por ejemplo, la edad al momento del diagnóstico se encuentra inversamente correlacionada al riesgo de malignización (edad mayor a 40 años al momento del diagnóstico demostró ser un factor de riesgo),27,28 así como aquellos pacientes que presenten déficit motor durante el examen físico prequirúrgico están asociados a una evolución menos favorable. Otros factores para tener en cuenta, según la Organización Europea de Investigación y Tratamiento del Cáncer (EORTC), incluyen la presencia de diámetro tumoral mayor a 6 cm o compromiso contralateral.27
Neuroimagenología
La evaluación en conjunto con un profesional en neuroimágenes resultara útil para definir la localización, características y, eventualmente, definir cómo abordar la lesión durante el acto quirúrgico. La resonancia magnética nuclear constituye el gold standard en la identificación no invasiva y diagnóstico de los gliomas de bajo grado.29 Por lo general, se puede sospechar la presencia de un glioma de bajo grado ante la presencia de lesiones isointensas o hipointensas en T1 e hiperintensas en T2 que frecuentemente no realzan tras la administración de contraste endovenoso y ausencia o escaso edema. A través de la misma, se podrá ver las áreas elocuentes que pueden verse comprometidas y realizar un examen físico dirigido acorde. Modalidades como la tractografía, con la cual se puede visualizar el compromiso o desplazamiento de los distintos tractos funcionales, o como la resonancia magnética funcional, resultarán provechosas en tanto puedan plantear la necesidad de alterar la vía de abordaje hacia la lesión o definir los límites de resección de la misma.
Valoración anestésica
El anestesista proveerá las condiciones necesarias para un ambiente quirúrgico seguro, y parte de su trabajo se enfocará en disminuir el estrés físico y psicológico impuesto en el paciente, con el objetivo de que pueda cooperar lo máximo posible. Por lo tanto, resulta vital que el profesional logre una óptima analgesia, prevención de náuseas y vómitos, una apropiada confortabilidad y ansiólisis, además de una adecuada sedación. El mantenimiento de una buena ventilación a través de una vía aérea asegurada, así como de la estabilidad hemodinámica y presión intracraneal normal, constituyen las bases para conservar una buena homeostasis.
Por todo lo antedicho, la evaluación preanestésica debe incluir la evaluación de la vía aérea superior, en especial la búsqueda de factores predictores de intubación dificultosa (por ejemplo, la escala de Mallampati), y del riesgo de apnea obstructiva (mayor en casos de obesidad, antecedentes de apnea del sueño y retrognatia), la cual constituye un criterio de exclusión. En el caso de pacientes epilépticos también deben evaluarse meticulosamente debido a que casos de convulsiones con pobre control resultan ser un criterio relativo de exclusión, teniendo en cuenta que las mismas pueden ser secundarias a una baja concentración sérica, a la técnica de neuroestimulación o drogas anestésicas utilizadas (opioides en altas dosis o neurolépticos). Curiosamente, aquellos pacientes con epilepsia no presentarían mayor riesgo de convulsiones intraquirúrgicas debido a neuroestimulación en comparación a aquellos pacientes sin antecedentes de convulsiones.30
No existe un consenso en relación con la premedicación, la cual dependerá de la experiencia y disponibilidad de fármacos por parte del equipo anestésico. Varios autores administran prequirúrgicamente antiinflamatorios no esteroideos, como por ejemplo el diclofenac o acetaminofeno y opioides como el fentanilo, para un buen manejo del dolor.18-20 Los corticoides se utilizan para reducir el efecto de masa y edema que pueda presentarse. Debido a que esta técnica puede favorecer la presentación de crisis comiciales, resulta de buena práctica mantener niveles terapéuticos séricos de anticomiciales en todo momento, así como durante el postoperatorio. La eventualidad de episodios eméticos podría representar un peligro por el riesgo de broncoaspiración, incremento de la presión intracraneal y agitación del paciente, por lo que deben prevenirse mediante la administración de fármacos protectores gástricos como la ranitidina, en combinación con antieméticos como el ondasentrón.31
Como se mencionó previamente, no existe un protocolo preestablecido, por lo que podrán existir diferencias entre los equipos de las distintas instituciones.
Valoración neuropsicológica
La presencia de un neuropsicólogo debe estandarizarse durante este tipo de procedimientos. Sera él quien apoyará al paciente durante una situación por demás especial y difícil que supone estar despierto durante la cirugía. Por tal motivo, resulta beneficiosa la visita del paciente al quirófano previo al día de la cirugía, guiada por el neuropsicólogo, con la finalidad de familiarizarlo con los sonidos y equipamiento presentes en el lugar, estableciendo un mayor grado de confianza personal y con los profesionales, lo cual supondrá una mejor colaboración durante el procedimiento despierto.
Además, será el responsable de mantener la atención y cooperación del paciente para evaluar satisfactoriamente las funciones neurocognitivas del mismo. Por ejemplo, definirá si una alteración, especialmente de la función del lenguaje, se encuentra alterada debido a la estimulación intraquirúrgica o por otro factor (estrés psicológico o físico, problemas de concentración, etc.)32
Para tal fin, el neuropsicólogo evaluará las habilidades en el lenguaje del paciente previo a la cirugía, haciendo uso de distintas pruebas, como el test de afasia de Aachen (AAT),32 complementado por diferentes definiciones de grado de afasia, por ejemplo:
El profesional, además, solicitará al paciente que realice distintos tipos de ejercicio durante la cirugía para evaluar la integridad del lenguaje durante la estimulación y/o resección tumoral (denominación de objetos, conjugación de verbos, contar números en distintas secuencias de lógica, etc.).
Por último, la función del neuropsicólogo no se limita exclusivamente al momento previo y durante la cirugía, ya que además puede guiar aspectos importantes de la neurorrehabilitación y entrenamiento cognitivo, considerando el gran número de pacientes que presentan un déficit temporal en el periodo postquirúrgico34 para que los pacientes puedas retomar sus funciones sociales y profesionales lo antes posible.
Neurointensivismo
Por lo general, se recomienda un seguimiento meticuloso del paciente en terapia intensiva por al menos 24-48 horas posteriores a cualquier procedimiento neuroquirúrgico de resección tumoral. Dicha recomendación se basa en la necesidad de identificar en forma precoz cualquier tipo de complicación postquirúrgica (de relativa baja frecuencia, pero nunca inexistentes) y así actuar en consecuencia al favorecer una eventual intervención temprana para lograr una recuperación más rápida y eficaz.
En aquellos casos que evolucionan de manera favorable y sin complicaciones, las intervenciones más frecuentes dentro de la unidad de terapia intensiva consisten en la administración de analgésicos intravenosos y/o mantener una presión media estable a través del suministro de antihipertensivos por infusión continua, con un objetivo de presión sistólica entre 100-140 mmHg, con la finalidad de prevenir episodios o crisis hipertensivas, las cuales se asocian a hemorragias intracraneales, mayor morbilidad y prolongación de la estadía hospitalaria.35
Por otra parte, resulta fundamental la instauración de una rehabilitación física temprana, incluso durante la internación en la sala de terapia intensiva, idealmente a cargo de un equipo que consista en kinesiólogos y terapistas ocupacionales, debido a la alta incidencia conocida de pacientes con déficits neurológicos transitorios postquirúrgicos.34,36-38 La intensidad y frecuencia de la rehabilitación se ajustará a las necesidades clínicas o déficits individuales de cada paciente, e incluirá movilización progresiva en casos de déficits motores, evaluación por un terapista ocupacional especialista en el habla, para aquellos casos de disfasias. Además, pacientes que presenten déficits cognitivos podrían beneficiarse del seguimiento y tratamiento neuropsicológico (Figura 2).
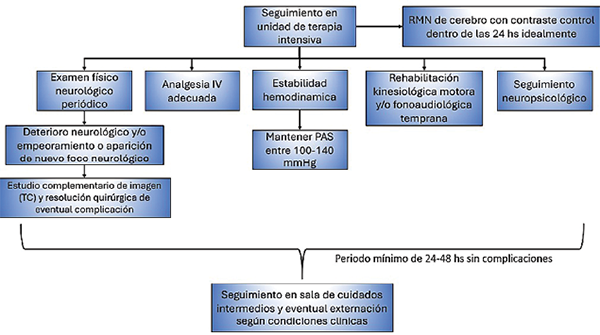
Figura 2. Diagrama de flujo durante la etapa postquirúrgica.
Preparación prequirúrgica
La noche previa a la cirugía se recomienda la administración de un ansiolítico/sedante oral (por ejemplo, Zolpidem 10 mg), no así el día de la cirugía, para no comprometer la cooperación del paciente durante la fase de la misma despierto.23 Si el paciente no se encuentra bajo tratamiento anticomicial, se recomienda una dosis de carga durante el procedimiento, cuyos niveles en sangre luego del mismo deben mantenerse ligeramente más elevados que lo normal para luego reducirlos paulatinamente.22
Como se comentó previamente, es recomendable ofrecer al paciente conocer el ambiente de quirófano, con la finalidad de establecer o afianzar el grado de confianza y disminuir su ansiedad, favoreciendo ulteriormente la colaboración del mismo durante la intervención. No existen numerosos estudios a la fecha que se hayan enfocado en las percepciones y/o expectativas del paciente con relación a la cirugía despierto, pero se ha observado una tendencia en la que los pacientes expresaron que su decisión de realizar el procedimiento quirúrgico fue basada en gran parte en base a la información que recibieron en forma previa por el profesional médico, con la cual fueron capaces de entender en mayor profundidad su patología y tipo de cirugía.40
Ergonomía de quirófano
La ubicación de los profesionales y equipamiento debe ser tal que permita la mayor fluidez en relación con el trabajo técnico de cada uno de los especialistas, y comunicación entre los mismos y/o con el paciente, libres de cualquier tipo de obstrucción para sus diferentes tareas. Para tal fin, en nuestra experiencia, ubicamos al equipo neuroquirúrgico por detrás de la cabecera de la camilla, el cual se encuentra a la derecha de la mesa de instrumentación quirúrgica, e inmediatamente a la izquierda del neurofisiólogo junto al equipo de estimulación y monitoreo neurofisiológico, con el objetivo de mantener un contacto estrecho con el mismo para identificar y así evitar lesionar las áreas elocuentes. En la parte caudal de la camilla, a la altura de los pies del paciente, se ubicará la mesa del médico anestesiólogo, en tanto, entre este último y el neurofisiólogo se emplazará el neuropsicólogo, quien establecerá contacto visual directo con la cara del paciente durante el procedimiento despierto. Dicho contacto no debe ser interrumpido por ninguna otra persona, equipo y/o campo quirúrgico, el cual se dispondrá de tal modo que permita dicha interacción (Figura 3).
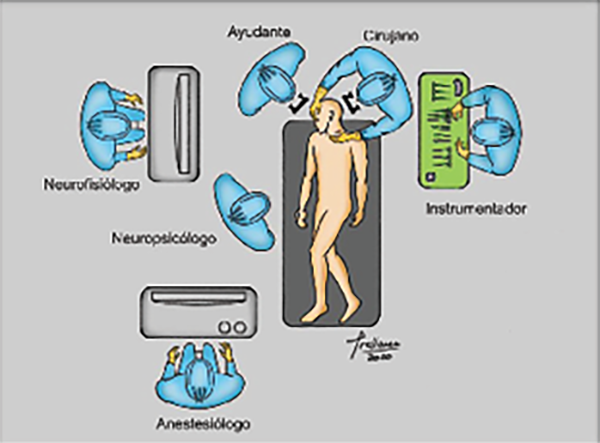
Figura 3. Ergonomía de quirófano.
Posicionamiento y abordaje
El paciente es posicionado en la camilla del quirófano, participando en forma activa para identificar y aliviar cualquier punto de apoyo y/o disconformidad que pueda sentir. No se deben menospreciar detalles como un ambiente en quirófano templado y uso de caloventores para evitar temblores durante la etapa de cirugía con el paciente despierto, y posicionadores de gel viscoelástico para proteger las zonas de decúbito, debido a que gran parte del éxito de la cirugía dependerá de la confortabilidad del paciente. Además, es importante mantener contacto visual directo con el campo visual del paciente, especialmente por parte del neuropsicólogo, evitando cubrir su cara con los campos estériles y desplazando cualquier elemento de quirófano que pueda obstaculizar una óptima interacción entre paciente y el profesional (Figura 4).
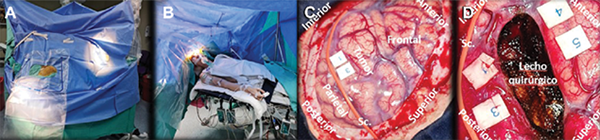
Figura 4. Ejemplo de caso de glioma de bajo grado en área de Broca (A-D). A. Vista en detalle de la posición del paciente en el quirófano y la disposición de los campos quirúrgicos durante craneotomía con paciente vigil y mapeo cortical. El posicionamiento debe realizarse previo a la inducción anestésica, con participación activa del paciente. B. Los campos estériles deben colocarse de manera tal que permitan una libre interacción entre el paciente y el neuropsicólogo, además de un adecuado manejo de la vía aérea. C y D. Documentación fotográfica intraquirúrgica previa y posterior a resección tumoral. La exéresis fue dirigida acorde a límites funcionales cortico-subcorticales, mediante mapeo cortical intraquirúrgico (cotonoides con referencia numérica: 1 y 3 corresponden a área motora de la mano; 4 y 5 evocaron un arresto del lenguaje bajo estimulación cortical). Se utilizó un loop vascular de silicona para delimitar el surco central. Se observa la cavidad de resección, con ausencia de márgenes entre límites funcionales por mapeo cortical y el tumor. El paciente presentó una disfasia de expresión leve postquirúrgica, la cual mejoró sustancialmente en un tiempo menor a 3 meses. Continúa actualmente realizando rehabilitación fonoaudiológica. Sc, Surco Central.
Se dispone al paciente en posición decúbito supino, con distintos grados de rotación cefálica en forma contralateral a la lesión, según la localización de la misma. El miembro superior homolateral permanecerá descansando al lado del cuerpo para así no incomodar a los neurocirujanos; mientras que el miembro superior contralateral, por lo general, se extenderá para facilitar su manipulación por el anestesista.
Luego de definida la posición en forma consensuada con el paciente, se procede a la inducción anestésica, tras la cual realizamos la infiltración con lidocaína con epinefrina del cuero cabelludo en los sitios donde fijamos la cabeza con cabezal de Mayfield de 3 pines en nuestro centro, lo cual puede obviarse según lo descripto en otros centros, donde apoyan la cabeza en un posicionador en forma libre. Posteriormente, es fundamental continuar con la infiltración con anestésico local para realizar un bloqueo regional óptimo en toda el área en la cual se realizará la incisión del scalp, idealmente desde el cigoma hasta la región media de la frente, incluyendo el área por encima del reborde supraorbitario, y por detrás de la incisión hasta la región posterior de la oreja, siempre con el objetivo de asegurar la máxima comodidad posible del paciente durante la fase despierta.22 Al momento de colocar los campos estériles, la cara y campo de visión del paciente deben quedar libres para una correcta comunicación con el neuropsicólogo y anestesista durante el despertar y pruebas del mapeo funcional, o manifestación de cualquier disconformidad.
Los pasos iniciales para realizar el abordaje quirúrgico no difieren en gran medida en comparación al procedimiento realizado bajo anestesia general, por lo cual no se detallarán. Por otra parte, es importante tener en cuenta algunas consideraciones asociadas al procedimiento con paciente despierto. Al momento de realizar la craneotomía no se debe escatimar en el diámetro de la misma, la cual debe estar centrada en la lesión, pero agregando un margen de al menos 2 a 4 cm, dependiendo del área cortical necesaria para realizar el mapeo de aquellas áreas elocuentes adyacentes a la misma. Por último, previo al momento de despertar al paciente, es recomendable infiltrar la duramadre con lidocaína al 1% en toda la región alrededor de la arteria meníngea media y realizar la durotomía una vez despierto y alerta, debido a la posibilidad de toser u otra maniobra de Valsalva durante el despertar que pueda causar herniación del parénquima (Figura 5).
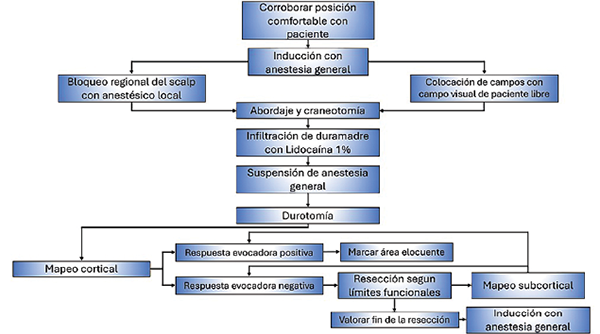
Figura 5. Diagrama de flujo durante la etapa intraquirúrgica.
Mapeo cortical
Debido a que las respuestas motoras evocadas son fáciles de objetivar, se comenzará por mapear la función motora (la cual puede ser monitoreada también en el paciente dormido)39. La presencia de un neuropsicólogo o neurólogo es muy importante especialmente para la evaluación del lenguaje y funciones cognitivas. Durante el mapeo, es prudente contar con la disponibilidad en la mesa quirúrgica de solución fisiológica fría como medida en contra de una eventual convulsión secundaria a la estimulación intraquirúrgica (Figura 6).
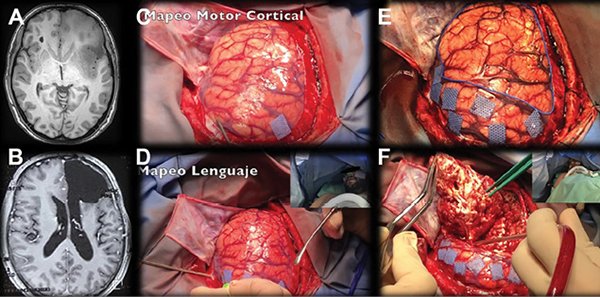
Figura 6. A. Ejercicio del área motora suplementaria y primaria (Tapping) en un tercer caso de una paciente femenina de 20 años, diestra, con diagnóstico de glioma de bajo grado en área premotora y motora primaria. La estimulación bloquea este ejercicio de coordinación. B. Cortes axiales de secuencia FLAIR de RMN prequirúrgica, en la cual se observa lesión glial de bajo grado hiperintensa en topografía de F1, F2 y giro precentral. C. Cortes axiales de secuencia FLAIR de RMN postquirúrgica, en la cual se observa pequeño remanente tumoral en F1 y giro precentral, debido a que la estimulación cortical en dichas áreas evocó una paresia del miembro superior derecho. La paciente evolucionó favorablemente, sin déficit motor, y retornó a una vida social y profesional normal, con una mejoría en su calidad de vida en comparación a las condiciones prequirúrgicas debido a convulsiones a repetición.
Para el mapeo, se aplicarán pulsos cortos con una frecuencia entre 25-60 Hz, y la intensidad de la estimulación debería incrementarse 1 mA progresivamente hasta objetivar respuesta motora o del registro del EMG (O hasta un máximo de 6mA)41. La misma intensidad debería usarse para el mapeo del resto de las funciones del lenguaje, cognitivas, etc. La duración de la misma se recomienda de unos 2 mseg. Otras recomendaciones generales incluyen la estimulación del área cortical expuesta cada 5 mm2, estimular cada sitio al menos en 3 oportunidades, pero nunca estimulando un mismo sitio en forma consecutiva, así como evaluar las funciones del paciente entre estimulaciones.42 Durante el mapeo del lenguaje, por otra parte, se recomiendan estímulos de 3-4 segundos con el fin de evocar una interferencia en el mismo y realizarla inmediatamente luego de que el paciente comience a hablar durante la evaluación para descartar una falta de colaboración ocasional o evento comicial temporal no convulsivo. Una respuesta negativa a la estimulación, es decir, una ausencia de deterioro en la función neurológica a evaluar, se interpretará como área no elocuente. Aquellas áreas que se objetiven como elocuentes, se marcarán con algodones estériles numerados. Finalmente, basándose en los hallazgos de la estimulación e identificación de dichas áreas elocuentes, se planea y se prosigue con el área de cortisectomía para dar comienzo a la resección tumoral (Figura 7).
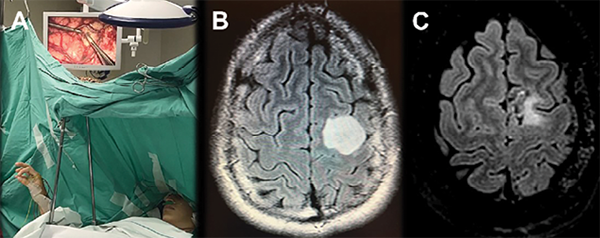
Figura 7. Paciente joven masculino con antecedentes de convulsiones, en cuyo contexto se diagnostica un glioma de bajo grado frontoinsular izquierdo. A. Cortes axiales de secuencia T1 de RMN que evidencian área hipointensa en topografía de F3 e ínsula izquierda con discreto efecto de masa asociado. B. Secuencia T1 con contraste de cortes axiales de RMN postquirúrgica del paciente. No ha presentado crisis comiciales posteriores a la resección tumoral. El paciente presentó una leve disfasia transitoria postquirúrgica, de la cual se recuperó en forma completa en el lapso menor a 1 mes con rehabilitación fonoaudiológica. C-F. Fotografías intraquirúrgicas en instancias previas y durante resección tumoral, utilizando límites funcionales cortico-subcorticales obtenidos durante estimulación cortical intraquirúrgica, como márgenes de resección, con el paciente despierto.
Mapeo subcortical
Los gliomas difusos, por naturaleza, infiltran los fascículos de sustancia blanca con el consiguiente porcentaje importante de morbilidad asociada a la cirugía, secundario a la injuria de vías funcionales subcorticales. Por lo tanto, para una resección segura, dichas vías funcionales deben ser identificadas también a nivel subcortical, a través de técnicas de estimulación para mapeo subcortical. Asimismo, en teoría, la cuantía de corriente necesaria para estimular un determinado fascículo de sustancia blanca puede correlacionarse con la distancia existente entra la sonda de estimulación y dicho fascículo.43 Según distintos estudios, la resección debería finalizar dentro de un margen de distancia de seguridad de las fibras de proyección motoras, el cual se correlacionaría con el rango de umbral de estimulación entre 1 a 10 mA.44 Continuar la resección con voltajes de corriente menores al rango comentado resulta en un riesgo y porcentaje aumentado de déficits neurológicos postquirúrgicos.
En lo que respecta a la anatomía de la sustancia blanca del cerebro, se pueden diferenciar 3 tipos de haces o tractos: de asociación, conectando regiones corticales diferentes dentro de un mismo hemisferio; de proyección, conectando la corteza con regiones más caudales del cerebro, tronco y medula espinal; y comisurales, conectando regiones de ambos hemisferios.
El objetivo del mapeo subcortical será identificar para evitar lesionar algunos de estos fascículos al formar parte de vías funcionales como la del lenguaje, motora, visual, entre otras.
En el caso de lesiones adyacentes al área motora primaria del giro precentral, resultará de vital importancia identificar el tracto corticoespinal a nivel subcortical durante su trayecto por la corona radiada hasta el brazo posterior de la cápsula interna.
En referencia al lenguaje, cabe mencionar particularmente los fascículos arcuato (su lesión se asocia a dificultades en la comprensión y repetición), fascículo uncinado (asociado a anomia y prosopagnosia en caso de injuria), fascículo longitudinal inferior (su compromiso puede expresarse en forma de alexia, agnosia visual o alucinaciones) y el fascículo fronto-occipital inferior (la lesión del fascículo dominante se correlaciona usualmente con anomia y parafasias).45
En relación con la función visual, se puede monitorizar a través del mapeo de las radiaciones ópticas, ya sea a nivel del Asa de Meyer, anterior al asta temporal y lateral a la cabeza del hipocampo; o las porciones sublenticular y retrolenticular de la cápsula interna. Su lesión dará como resultado déficits campimétricos contralaterales y, en caso de lesión del hemisferio no dominante, puede relacionarse a alteraciones en la percepción visuo-espacial o negligencia.46
Durante el mapeo subcortical se irán aplicando los mismos principios de estimulación. Se recomienda, además, incrementar la intensidad en 2 mA y repetir la estimulación regularmente mientras se mapea el trayecto del haz, lo cual demostró ser eficaz para evitar la lesión iatrogénica.47
DISCUSIÓN
Dentro de las estrategias quirúrgicas de los gliomas de bajo grado el control expectante fue una de las conductas más comúnmente utilizadas en estos casos38,48 debido al curso evolutivo indolente y a la creencia de que este tipo de lesiones no progresaban a lesiones con mayor grado de anaplasia, respaldado por estudios retrospectivos que no demostraban diferencia estadísticamente significativa en cuanto a la sobrevida, cuando se optaba por diferir la terapéutica.41
Contrariamente, este último concepto de “benignidad” de los gliomas de bajo grado fue ampliamente refutado.9,28,37,49 Si bien no existen estudios randomizados entre un grupo de pacientes operados y otro control, de manejo expectante, existen estudios descriptivos retrospectivos que evidencian un aumento de la sobrevida significativo en pacientes pertenecientes al primer grupo.38,50 Por su parte, Claus y colaboradores, demostraron que resecciones mayores a 90% o remanentes tumorales menores a 10 ml, implican factores independientes directamente relacionados con la sobrevida, período libre de enfermedad y transformación maligna en pacientes afectados por gliomas de bajo grado.48
Sin embargo, la mayoría de los pacientes con diagnóstico de glioma de bajo grado desarrollan sus actividades diarias, sociales y/o laborales con frecuente normalidad, asociado a una expectativa de vida variable, la cual puede ser relativamente prolongada independientemente del tratamiento terapéutico, por lo que los posibles riesgos de una cirugía de resección temprana y radical podrían impresionar injustificados, tanto para el paciente como el profesional.
En años previos, la cirugía de resección de gliomas de bajo grado se enfocaba principalmente en la sobrevida del paciente, relevando a un segundo plano el estado funcional del mismo. Actualmente, el objetivo se centra en lograr el mayor grado de resección posible, disminuyendo la morbilidad al mínimo, con la finalidad de que el paciente pueda continuar desarrollando su vida social y profesional en forma plena.
Por tal motivo, la neurocirugía con el paciente despierto y mapeo cerebral intraquirúrgico resulta ser idónea en la resección de gliomas adyacentes a áreas elocuentes, permitiendo lograr un equilibrio entre resección máxima tumoral, con conservación de las funciones neurológicas, con un grado de seguridad y confianza superior en relación con el mismo procedimiento bajo anestesia general que no puede obtenerse con otros métodos.13,28,34,51,52 Lo antedicho motivó un aumento significativo en la indicación de resección quirúrgica para aquellos gliomas, clásicamente considerados inoperables en el pasado.53
En un metaanálisis publicado por De Benedictis y colaboradores, de 1460 pacientes sometidos a resección de gliomas, el cual incluía 522 gliomas de bajo grado, se observó que el uso de mapeo eléctrico intraquirúrgico disminuyó la incidencia de déficit neurológico permanente a un 4.1%;54 y a 4.2% en otra serie de 834 pacientes con glioma (siendo 358 de bajo grado), en contrapartida a un 19% de déficit definitivo en distintas series en las cuales no se utilizó el mapeo intraquirúrgico.53
De Witt Hamer evaluó la utilidad del presente método, en el cual se evidenció una disminución de la morbilidad del 58%,34 así como un aumento en el porcentaje de pacientes en quienes se lograron resecciones totales (nivel de evidencia grado II).38
Otros métodos, como la RMN funcional, fueron objeto de comparación con el mapeo cortical intraoperatorio, presentando una sensibilidad de 71% para áreas relacionadas a la función motora y solo un 66% para aquellas relacionadas al lenguaje.15,16 La capacidad de la RMN intraoperatoria para detectar tumor residual es óptima,24 pero su idoneidad para aportar información funcional de manera eficiente en el tiempo en los procedimientos con el paciente despierto resulta discutible por lo antedicho. Más aún, teniendo en cuenta que el paciente puede fatigarse y cooperar en menor medida con el transcurso del mismo, la RMN intraoperatoria puede llegar a perjudicar la evaluación funcional del paciente.55
Los beneficios aportados a través de la cirugía con protocolo de paciente despierto y mapeo intraquirúrgico con electroestimulación fueron claramente demostrados en numerosas series; sin embargo, la misma es llevada a cabo en menos del 22% de las cirugías de glioma.56 Esto puede deberse a la falta de instrumental necesario (dispositivos de estimulación y para monitorear los parámetros de estimulación) y/o especialistas en Neurofisiología, Neuropsicología y Neuroanestesia.
La gran y compleja coordinación multidisciplinar entre un numeroso grupo de profesionales, así como la considerable cantidad de pasos a seguir que implica un procedimiento neuroquirúrgico con el paciente despierto durante el mismo, conlleva a plantear la necesidad de protocolizar dicha intervención, con el objetivo de ofrecer una guía detallada, pero que al mismo tiempo sea fácil de comprender y reproducir en un intento para alentar a un número cada vez mayor de profesionales de considerar llevarla a cabo, previo a una cuidadosa y correcta selección del paciente. A través de la labor conjunta multidisciplinaria y familiarización de la técnica se podrán obtener resultados cada vez más exitosos, especialmente en lo relacionado a la morbilidad asociada a la resección de gliomas de bajo grado con compromiso de áreas elocuentes.
A pesar de las series publicadas con reportes de fracaso del 2.3%-6.4% y de complicaciones del 14%-32%,57 la información previamente comentada con relación a la cirugía con el paciente despierto y mapeo funcional cerebral ilustra una técnica que ofrece un alto grado de éxito asociado a un bajo riesgo de morbilidad.58-60
CONCLUSIONES
Se propuso un protocolo guía con el objetivo de facilitar y agilizar el trabajo coordinado y multidisciplinar entre numerosos profesionales con formación en neurociencias, ya sea tanto en quirófano, como en lo relacionado a una cuidadosa selección de paciente durante la etapa prequirúrgica o los cuidados postquirúrgicos en la unidad de terapia intensiva. El planteo surge de nuestra creencia en que gran parte del éxito del procedimiento quirúrgico dependerá, no solo del punto de vista técnico, sino también de una óptima coordinación de las distintas tareas específicas que ejercerá cada profesional en las sucesivas etapas de atención del paciente.
BIBLIOGRAFÍA
COMENTARIO
Los autores detallan con precisión una guía estandarizada en el manejo neuroquirúrgico de Gliomas de bajo grado en áreas elocuentes con paciente despierto.
Cabe destacar para los neurocirujanos más jóvenes en formación la necesidad imperiosa de contar como estudio prequirúrgico una RMN Funcional con paradigma motor y del lenguaje, esencial para la planificación preoperatoria. También con la posibilidad de contar con métodos de localización intraoperatoria como ser neuronavegación, estereotaxia o ecografía, sumado al monitoreo neurofisiológico intraoperatorio.
Está ampliamente difundida la utilidad de la craneotomía con paciente despierto en la resección de tumores en el área del lenguaje, no así en tumores de otra localización.
En la utilidad se disponen de software de planificación prequirúrgica más avanzados que permiten no sólo la localización anatómica de áreas elocuentes y fibras de asociación, sino también la interconexión entre ellas, de manera de establecer circuitos neuronales implicados en distintas funciones neurológicas (redes neuronales no tradicionales), como ser la Red sensoriomotora, el Sistema límbico, la Red de atención Dorsal, La Red visual, y muchas más, solo realizando una Tractografía a través del DTI.
La Tecnología puesta al servicio de la neurocirugía permite cirugías con máxima resección y preservación funcional con el impacto que esto produce en la recuperación de los pacientes portadores de tumores cerebrales.
Pablo Landaburu
Hospital Luisa C. De Gandulfo. Provincia de Buenos Aires, Argentina
COMENTARIO
La resección quirúrgica juega un papel central en el tratamiento de los gliomas y cada vez hay más evidencia sobre el valor de la extensión de la resección con el objeto de mejorar la sobrevida global, la progresión de la enfermedad , el tiempo hasta la transformación maligna y el control de las convulsiones.1
Por otro lado, el mapeo cerebral intraoperatorio es la mejor técnica estandarizada para la identificación y preservación de áreas funcionales corticales y subcorticales. Una sólida comprensión de la neuroanatomía mejora la seguridad, y los objetivos quirúrgicos deben equilibrarse con la preservación del lenguaje, las redes motoras y neurocognitivas.
Los pacientes candidatos para una craneotomía despiertos son aquellos que presentan una lesión intrínseca supratentorial ubicada dentro o adyacente a regiones que se supone tienen función del lenguaje o sensoriomotora en las imágenes preoperatorias.
Los autores presentan una guía clara y práctica de cómo y cuándo realizar la cirugía con el paciente despierto. El uso adecuado de esta técnica en el campo de la neurooncología ha disminuido los déficits neurológicos postoperatorios, ha permitido una resección tumoral máxima segura y ha mejorado la administración de los recursos pudiendo permitir el alta temprana de los pacientes.2 Debido a todo esto, este artículo resulta sumamente útil y práctico.
Pablo Ajler
Jefe de Servicio de Neurocirugía. Hospital Italiano de Buenos Aires
BIBLIOGRAFÍA