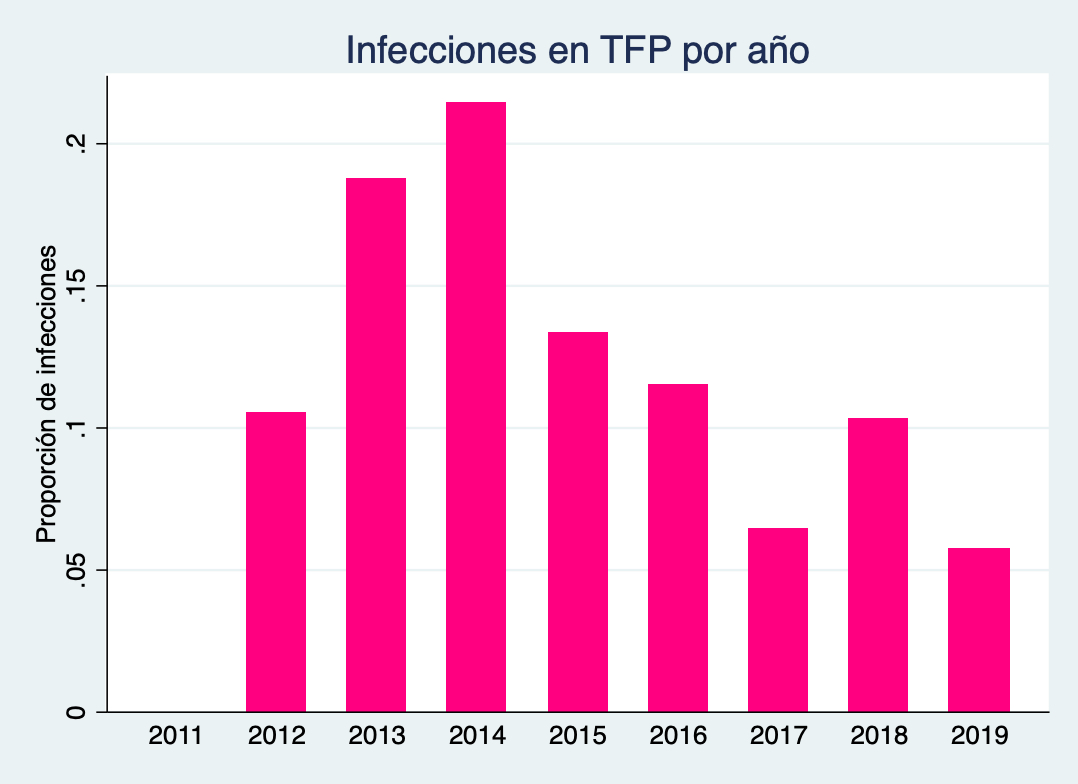
Figura 1: Proporción de infecciones por año.
Factores de riesgo para infecciones del sitio quirúrgico en tumores de fosa posterior
Eugenia Badaloni y Miguel Grijalba
Hospital de Pediatría Juan P. Garrahan
Introducción: Los tumores de fosa posterior son la patología oncológica más frecuente en pediatría con
la exéresis quirúrgica como principal tratamiento1–3. El hecho de que sea un procedimiento frecuente
no hace que se encuentre exento de complicaciones, como infecciones del sitio quirúrgico 4,5. El
objetivo principal es conocer los factores de riesgo que se asocian a infecciones del sitio quirúrgico
posterior a la exéresis de tumores de fosa posterior en una población completamente pediátrica.
Metodología: Se realizó un estudio de casos y controles retrospectivo donde se analizaron todas las
cirugías de tumores de fosa posterior que se realizaron en nuestro hospital entre enero del 2014 a mayo
del 2020. Se incluyeron como casos a todos los pacientes que presentaron una infección del sistema
nervioso central postoperatoria y como controles a los que pacientes que se operaron y no presentaron
infección.
Resultados: Al analizar los factores de riesgo encontramos que los pacientes con colocación de DVP
(p=0.03) o DVE (p=0.005) tienen mayor chance de presentar infección del sitio quirúrgico en el
postoperatorio. Mayor valor de Hemoglobina (p=0.002) parecería ser un factor preventivo. Las cirugías
prolongadas (p<0.001) y la fístula a través de la herida (p=0.002) aumentan s las chances de infección del
sitio quirúrgico en el postoperatorio.
Conclusiones: Algunas estrategias que podrían ayudar a reducir el número de infecciones son: un
adecuado control de la hidrocefalia prequirúrgica, preferentemente mediante TVE; reducir al mínimo el
tiempo quirúrgico necesario para realizar el procedimiento; ingresar a quirófano con una hemoglobina
adecuada y evitar la fístula de líquido por la herida
Palabras clave: Complicaciones quirúrgicas – Tumores de fosa posterior – Infecciones – Morbilidad –
Factores de riesgo
INTRODUCCIÓN
Los tumores de fosa posterior son la patología oncológica más frecuente en pediatría con la exéresis quirúrgica como principal tratamiento1–3. El hecho de que sea un procedimiento frecuente no hace que se encuentre exento de complicaciones, dentro de éstas una de las más frecuentes son las infecciones asociadas al sitio quirúrgico, que se estima tienen una frecuencia que ronda entre el 1-25%4,5.
Las infecciones postoperatorias acarrean múltiples complicaciones para el paciente como para el sistema de salud, desde alteraciones neurocognitivas, elevada morbi-mortalidad, mayor utilización de recursos hospitalarios, y costos elevados6,7.
Se han enumerado diferentes factores de riesgo para infecciones del sitio quirúrgico en neurocirugía8– 11, sin embargo, estos estudios incluyen dentro de un mismo análisis poblaciones de pacientes pediátricos y adultos, cirugías supratentoriales como infratentoriales, de diferente complejidad.
Es por esto que nos propusimos diseñar un estudio en el que el objetivo principal es conocer los factores de riesgo que se asocian a infecciones del sitio quirúrgico posterior a la exéresis de tumores de fosa posterior en una población completamente pediátrica.
METODOLOGÍA
Se realizó un estudio de casos y controles retrospectivo donde se analizaron todas las cirugías de tumores de fosa posterior que se realizaron en el Hospital de Pediatría Juan P. Garrahan entre enero del 2014 a mayo del 2020. Se incluyeron como casos a todos los pacientes que presentaron una infección del sistema nervioso central postoperatoria y como controles a los que pacientes que se operaron y no presentaron infección.
Se incluyeron todos los pacientes operados de un tumor de fosa posterior en nuestra institución, menores de 18 años, con un seguimiento mínimo de un mes postoperatorio. Se excluyeron pacientes con tumores de tronco, con lesiones no oncológicas por anatomía patológica o datos incompletos en la historia clínica.
Variables
La variable de resultado fue la presencia de infección postoperatoria dentro de los 30 días posteriores a la cirugía de exéresis tumoral. Los criterios para definir la infección postoperatoria fueron: infección en el sitio quirúrgico diagnosticado por cultivo positivo de punción de colección en la lodge o cultivo positivo de LCR tomado por punción lumbar, de reservorio o a través de un sistema de derivación ventricular al exterior (DVE) y síntomas sugestivos de infección en el sitio quirúrgico. También se definió como infección postoperatoria a los pacientes que presenten una imagen en la fosa posterior sugestiva de proceso infeccioso como, absceso definido como una imagen cercana a la lodge quirúrgica que realce con contraste y/o restrinja en difusión, o un empiema definido como una imagen subdural o extradural que realce con contraste, con diferente densidad en el interior y/o restricción en la difusión.
No se consideró como infección postoperatoria los pacientes portadores de una derivación ventrículo peritoneal (DVP) o DVE que hayan presentado una infección asociada al sistema previo a la fecha de la
cirugía. Tampoco se consideró como infección postoperatoria a las infecciones superficiales de partes blandas sin compromiso intracraneano.
Se analizaron como variables independientes 24 factores de riesgo para infecciones postoperatorias. Se dividieron en factores prequirúrgicos, intraquirúrgicos y postoperatorios.
Los factores prequirúrgicos fueron edad, género, comorbilidades, índice de masa corporal (categorizado como desnutrición <18.5, peso estándar 16.6-24.9 y sobrepeso/obesidad >25), localización principal de la lesión (línea media o hemisférica), colocación de DVP o DVE o realización de una tercer ventriculostomía endoscópica hasta 30 días previos a la cirugía de exéresis tumoral o en el mismo acto quirúrgico, quimioterapia, radioterapia o necesidad de corticoides hasta 30 días previos a la cirugía, presencia de una infección fuera del SNC un mes previo a la cirugía, hemoglobina previa al ingreso a quirófano y días de internación previos a la cirugía.
Los factores intraquirúrgicos analizados fueron, clasificación de la Asociación Americana de Anestesia (ASA), tipo de cirugía (primaria o re cirugía), tiempo de cirugía (urgencia o programada), tipo de incisión (línea media o lateralizada), tipo de resección (Biopsia <59%, exéresis parcial 60-95% o exéresis completa >95%), uso de microscopio, aspirador ultrasónico, ecografía (ECO) intraoperatoria, monitorización neurofisiológica, neuronavegador, plaquetas y tornillos o adhesivo de fibrina, necesidad de realizar una plástica dural, número de personal estéril y duración de la cirugía en minutos.
Los factores postoperatorios analizados fueron la presencia de fístula por la herida, sangrado en la lodge quirúrgica mayor a 1 cm diagnosticado por imágenes y días de internación luego de la cirugía.
Análisis estadístico
Las variables categóricas se presentaron como frecuencias absolutas y porcentaje, las variables continuas como media y desvío estándar (DE). Para analizar cómo influyen los diferentes factores en la presencia de una infección en el postoperatorio se realizó un análisis de regresión lineal. Los resultados se presentaron con sus respectivos odds ratio (OR), DS, intervalo de confianza del 95% y p valor. Se consideró como estadísticamente significativo los valores de p<0.05. Para el análisis estadístico usamos STATA IC/15.1 (StataCorp 4905 Lakeway Dr College Station, TX 77845, USA)
RESULTADOS
Se encontraron un total de 256 cirugías de lesiones de fosa posterior, se excluyeron 16 pacientes con lesiones no oncológicas y 5 pacientes por presentar datos incompletos. Se analizaron un total de 235 cirugías de tumores de fosa posterior entre enero del 2014 y enero del 2020. De las cirugías analizadas el 57.94% (135) correspondía a pacientes de sexo masculino y la media de edad fue de 7.26 años (4.45) con un rango entre 1 y 18 años.
Las características generales de los pacientes se encuentran resumidas en la Tabla 1. La anatomía patológica más frecuente fue meduloblastoma en el 34.47% (81) de los casos, seguido por astrocitoma pilocítico en el 32.77% (77) de los casos y ependimoma en el 13.62% (32) de los casos. El resto de las anatomías patológicas fueron infrecuentes y se encuentran descriptas en la Tabla 2.
Tabla 1: Características generales de la población
Factores |
Sin infección (n=209) |
Con infección (n=26) |
Total (n=235) |
Género (n y %) |
|
|
|
Femenino |
87 (42.03%) |
15 (57.69%) |
98 (42.6%) |
Masculino |
120 (57.97%) |
11 (42.71%) |
135 (57.94%) |
Edad en años (Media y DS) |
7.39 (4.43) |
6.19 (4.61) |
7.26 (4.45) |
Comorbilidades (n y %) |
|
|
|
Ninguna |
202 (96.65%) |
24 (92.1) |
226 (96.17%) |
Dislipemia |
1 (0.48%) |
0 |
1 (0.43%) |
Insuficiencia renal |
0 |
1 (3.85%) |
1 (0.43%) |
Panhipopituitarismo |
0 |
0 |
1 (0.43%) |
Von Hippel Lindau |
0 |
1 (3.85%) |
1 (0.43%) |
Neurofibromatosis |
2 (0.96%) |
0 |
2 (0.85%) |
Síndrome de Down |
1 (0.48%) |
0 |
1 (0.43%) |
Tumor fuera del SNC |
3 (1.44%) |
0 |
3 (1.28%) |
IMC |
|
|
|
<18.5 |
4 (1.19%) |
1 (3.85%) |
5 (2.13%) |
18.6 - 24.9 |
193 (92.34%) |
23 (88.46%) |
219 (91.91%) |
>25 |
12 (5.74%) |
2 (7.69%) |
14 (5.96) |
Localización lesión (n y %) |
|
|
|
Línea media |
148 (70.81%) |
21 (80.77%) |
196 (71.91%) |
Hemisférico |
61 (29.19%) |
5 (19.23%) |
66 (28.09%) |
DVP precx (n y %) |
7 (3.35%) |
2 (7.69%) |
9 (3.83%) |
DVE precx (n y %) |
12 (5.74%) |
6 (23.08%) |
18 (7.66%) |
TVE precx (n y %) |
33 (15.79%) |
6 (23.08%) |
39 (16.60%) |
Quimioterapia precx (n y %) |
1 (0.48%) |
0 |
1 (0.43%) |
Radioterapia precx (n y %) |
0 |
0 |
0 |
Corticoides precx (n y %) |
193 (92.34%) |
25 (96.15%) |
218 (92.77%) |
Infección fuera del SNC precx (n y %) |
3 (1.44%) |
1 (3.85%) |
4 (1.70%) |
Hemoglobina (media y DS) |
12.62 (1.15) |
11.21 (1.90) |
12.46 (1.33) |
ASA (n y %) |
|
|
|
1 |
5 (2.39%) |
0 |
5 (2.13%) |
2 |
69 (33.01%) |
9 (34.62%) |
78 (33.19%) |
3 |
122 (58.37%) |
17 (65.38%) |
139 (59.15%) |
4 |
13 (6.22%) |
0 |
13 (5.53%) |
Tipo de cirugía (n y %) |
|
|
|
Primaria |
171 (81.82%) |
20 (76.92%) |
191 (81.28%) |
Re cirugía |
38 (18.18%) |
6 (23.08%) |
44 (18.72%) |
Tiempo de cirugía (n y %) |
|
|
|
Urgencia |
3 (1.44%) |
1 (3.85%) |
4 (1.70%) |
Programada |
206 (98.56%) |
25 (96.15%) |
231 (98.30%) |
Tipo de incisión (n y %) |
|
|
|
Línea media |
180 (86.12%) |
23 (88.46%) |
203 (86.38%) |
Lateralizada |
29 (13.88%) |
3 (11.54%) |
32 (3.26%) |
Tipo de resección (n y %) |
|
|
|
Biopsia |
1 (0.48%) |
0 |
1 (0.43%) |
Exéresis parcial |
101 (48.33%) |
15 (57.69%) |
116 (49.63%) |
Exéresis completa |
107 (51.20%) |
11 (42.31%) |
118 (50.21%) |
Uso de microscopio (n y %) |
204 (97.61%) |
25 (96.15%) |
229 (97.45%) |
Uso de ECO (n y %) |
6 (2.87%) |
0 |
6 (2.55%) |
Uso aspirador ultrasónico (n y %) |
43 (20.57%) |
3 (11.54%) |
46 (19.57%) |
Uso NNV (n y %) |
2 (0.96%) |
0 |
2 (0.85%) |
Uso monitorización (n y %) |
5 (2.39%) |
0 |
5 (2.13%) |
Uso de plaquetas (n y %) |
0 |
1 (3.85%) |
1 (0.43%) |
Uso de adhesivo de fibrina (n y %) |
129 (61.72%) |
19 (73.08%) |
148 (62.89%) |
Personal estéril en la cx (Media y DS) |
5.19 (1.07) |
5.26 (1.18) |
5.2 (1.08) |
Plástica dural (n y %) |
99 (47.37%) |
18 (69.23%) |
117 (49.79%) |
Duración cirugía en minutos (Media y DS |
349.75 (154.73) |
540 (137.58) |
370.80 (163.95) |
Días de internación precx (Media y DS) |
4.20 (4.89) |
2.80 (2.54) |
4.04 (4.70) |
Sangrado POP (n y %) |
8 (3.83%) |
1 (3.85%) |
9 (8.38%) |
Fistula por la herida POP (n y %) |
3 (1.44%) |
7 (26.92%) |
10 (4.26%) |
Días de internación postcx (Media y DS) |
22.09 (23.45) |
39.61 (26.71) |
24.21 (24.48) |
Tabla 2: Anatomía patológica de las lesiones
Anatomia Patologica (n y %) |
Total |
Astrocitoma Pilocitico |
77 (32.77%) |
Ependimoma |
32 (13.62%) |
Ependimoma anaplasico |
1 (0.43%) |
Meduloblastoma |
81 (34.47%) |
Meduloblastoma desmoplasico |
5 (2.13%) |
Ganglioglioma |
5 (2.13%) |
Papiloma de plexo |
6 (2.55%) |
Tumor glial de alto grado |
10 (4.26%) |
Hemangioblastoma |
4 (1.70%) |
Teratoide rabdoide atipico |
5 (2.13%) |
PNET |
2 (0.85%) |
Meningioma |
3 (1.28%) |
Metastasis |
4 (1.70%) |
La incidencia de infecciones postoperatorias en la cirugía de exéresis de tumores de fosa posterior entre las fechas elegidas fue del 11.06% (26). La incidencia por año se grafica en la Figura 1, el año con menor incidencia de infecciones fue el 2019 con 5.56%.

Figura 1: Proporción de infecciones por año.
Los gérmenes fueron rescatados por punción lumbar en 10 (40%) casos, por toma de muestra a través del DVE en 7 casos (28%), por punción de la colección del sitio quirúrgico en 6 (24%) casos y por punción de DVP en 2 (8%) casos. Los gérmenes aislados fueron Staphylococcus Epidermidis en 10 casos (38.46%), Staphylococcus Aureus en 6 casos (23.08%), Klebsiella Pneumoniae en 4 casos (15.38%), Pseudomonas Aeruginosa en 2 casos (7.69%), y en 1 solo caso (3.85%) en Acinetobacter baumannii y Staphylococcus Capitis. En 2 casos (7.96%) no se logró recate de germen y el diagnóstico se realizó por presencia de imagen sugestiva de infección y clínica del paciente. Pasaron una media de 4.2 días (7.45) entre la cirugía y el diagnóstico de infección.
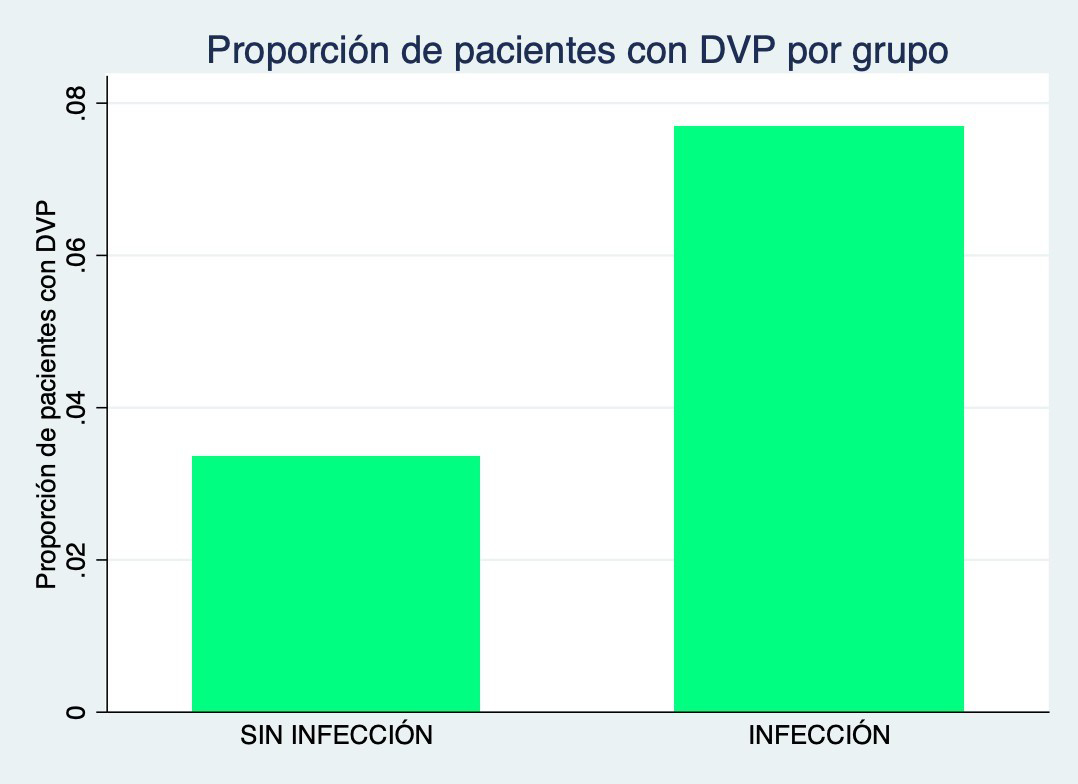
Figura 2: Gráfico de proporción de pacientes con DVP categorizado por infección
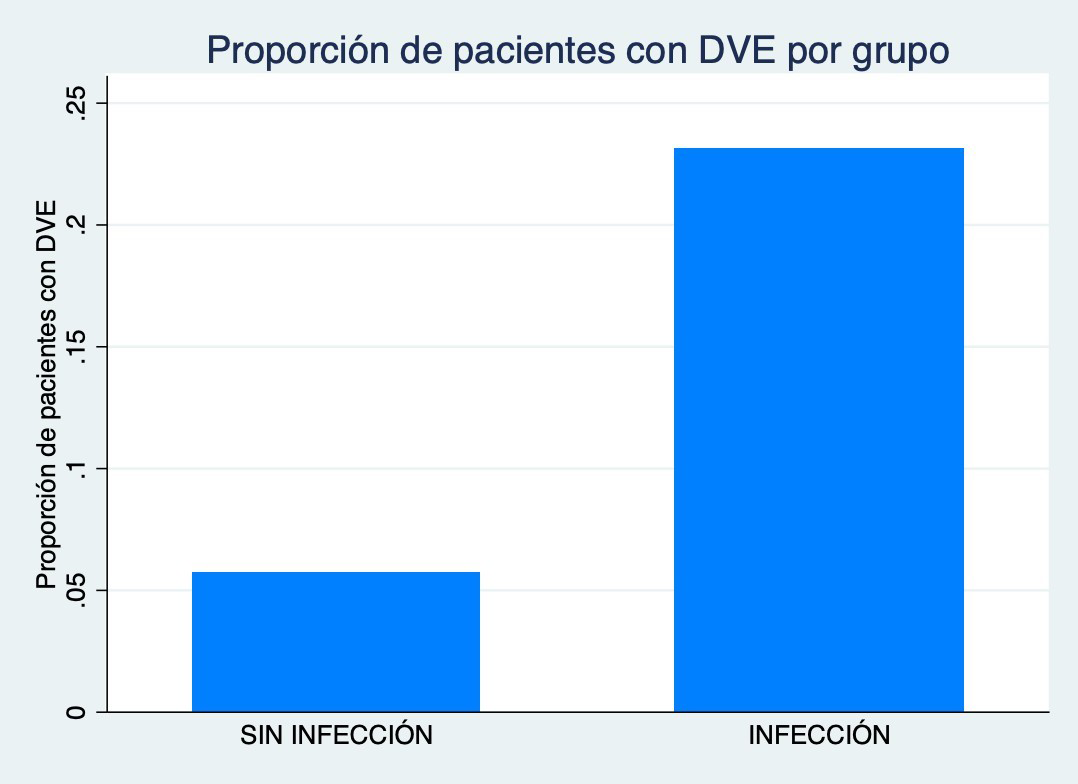
Figura 3: Gráfico de proporción de pacientes con DVE categorizado por infección
Cuando analizamos las diferentes características prequirúrgicas encontramos que los pacientes con colocación de DVP (p=0.03) o DVE (p=0.005) tienen mayor chance de presentar infección del sitio quirúrgico en el postoperatorio (Figura 2-3). Mientras que a mayor valor de Hemoglobina (p=0.002) menos chances de presentar una infección en el postoperatorio (Figura 4).
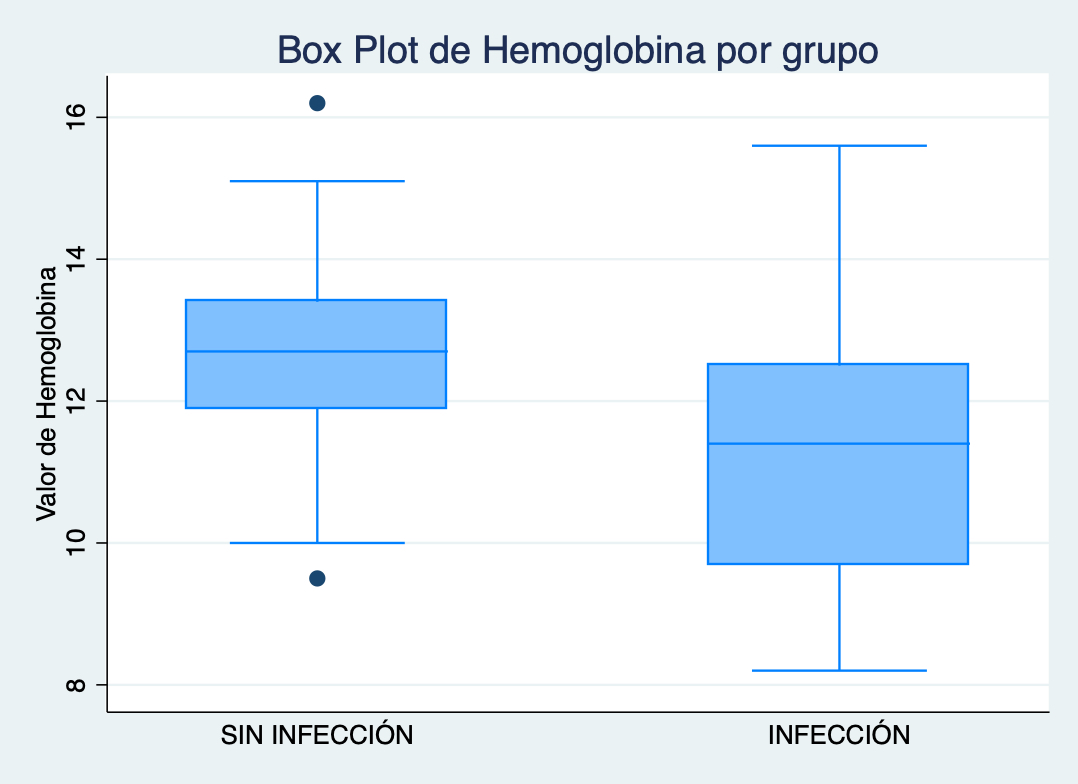
Figura 4: Box plot de hemoglobina categorizado por grupo
Cuando analizamos los factores intraquirúrgico encontramos que cirugías más prolongadas (p<0.001) aumentan las chances de presentar una infección del sitio quirúrgico en el postoperatorio (Figura 5).

Figura 5: Box plot de duración de la cirugía en minutos categorizado por infección
En cuanto a las características postoperatorias encontramos que la fístula de LCR a través de la herida (p=0.002) aumentan significativamente las chances de infección del sitio quirúrgico en el postoperatorio (Figura 6).
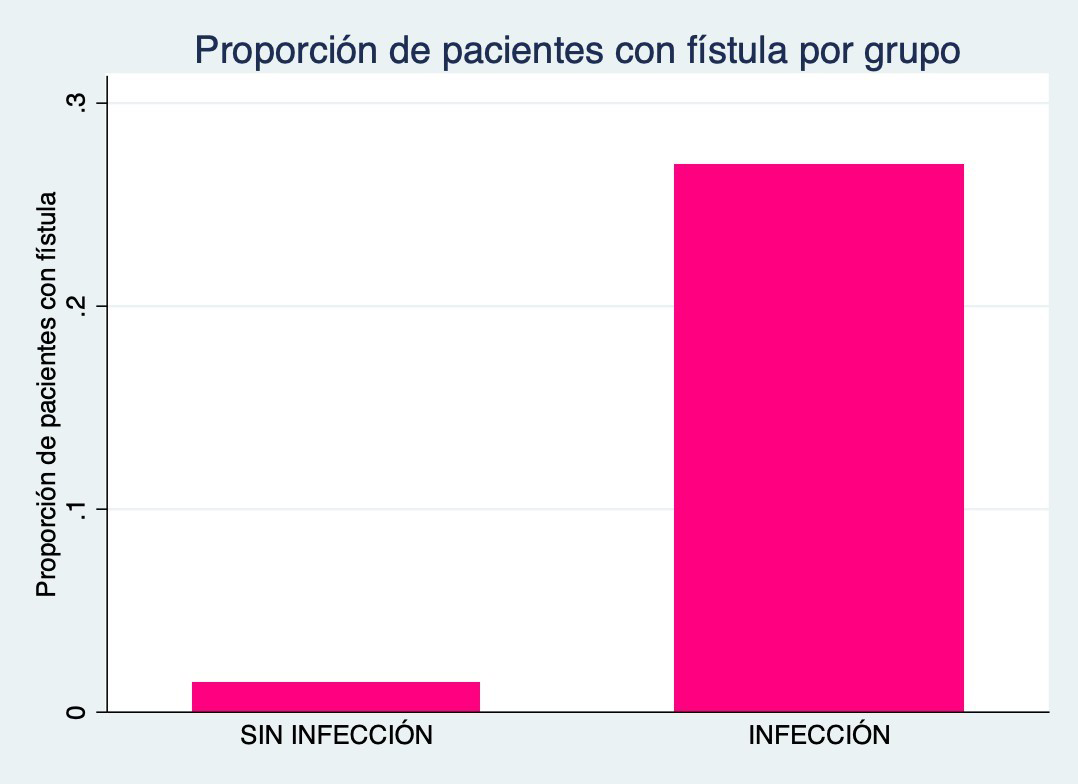
Figura 6: Proporción de pacientes con fístula categorizado por infección
El uso de microscopio (p=0.07) como la cirugía de urgencia (p=0.07) presentan cierta tendencia hacia infección del sitio quirúrgico en el postoperatorio sin embargo los resultados no fueron estadísticamente significativos. En la Tabla 3 se resumen los resultados de la regresión logística.
Tabla 3: Resultados de regresión logística
Caracteristica |
OR |
DS |
IC95% |
p-valor |
Género |
1.01 |
0.77 |
0.2-4.5 |
0.98 |
Edad |
0.91 |
0.09 |
0.7-1.1 |
0.38 |
Comorbilidades |
1.39 |
0.34 |
0.9-2.1 |
0.12 |
IMC |
2.95 |
3.6 |
0.2-32.2 |
0.37 |
Localización |
0.51 |
0.54 |
0.6-4.2 |
0.43 |
DVP |
41.14 |
28.1 |
1.6-70.3 |
0.03 |
DVE |
19.77 |
20.5 |
2.5-59.8 |
0.005 |
TVE |
0.3 |
0.39 |
0.2-3.8 |
0.35 |
Corticoides |
4.39 |
6.46 |
0.2-78.6 |
0.31 |
Infección fuera del SNC |
4.73 |
7.77 |
0.1-11.9 |
0.34 |
Hemoglobina |
0.42 |
0.11 |
0.2-0.7 |
0.002 |
ASA |
0.69 |
0.45 |
0.1-2.4 |
0.57 |
Tipo de cirugía |
6.7 |
7.12 |
0.8-53.8 |
0.07 |
Tiempo de cirugía |
8.68 |
23.69 |
0.4-45.5 |
0.43 |
Tipo de incisión |
2.89 |
3.48 |
0.2-30.6 |
0.37 |
Tipo de resección |
2.02 |
1.47 |
0.4-8.4 |
0.33 |
Uso de microscopio |
134.3 |
364.4 |
0.65-2274.4 |
0.007 |
Uso de aspirador |
0.22 |
0.24 |
0.2-1.9 |
0.17 |
Uso de adhesivo de fibrina |
1.51 |
1.18 |
0.3-7.1 |
0.59 |
Personal estéril |
0.67 |
0.24 |
0.3-1.3 |
0.28 |
Plástica de duramadre |
1.43 |
3.48 |
0.2-6.9 |
0.65 |
Duración cirugía |
1.01 |
0.002 |
1.00-1.02 |
<0.001 |
Sangrado postoperatorio |
1.05 |
2.47 |
0.1-103.7 |
0.98 |
Fistula del LCR |
58.74 |
76.07 |
4.6-105.5 |
0.002 |
DISCUSIÓN
Las infecciones del sitio quirúrgico son responsables de una elevada morbi-mortalidad en el paciente neuroquirúrgico, además de prolongar la estadía hospitalaria, aumentar exponencialmente la utilización de recursos hospitalarios, y elevar los costos para el sistema de salud6,12,13. La frecuencia de infecciones postoperatorias en neurocirugía ronda entre el 1-25%8. La variabilidad de resultados se debe a que la mayoría de los trabajos incluyen los diferentes procedimientos neuroquirúrgicos dentro de un mismo análisis, cuando está comprobado que algunos procedimientos presentan mayor riesgo de infección que otros, como puede ser las cirugías de fosa posterior5,14. Al mismo tiempo estas series suelen reportar los resultados en pacientes pediátricos como adultos. Sin embargo, los pacientes pediátricos tienen mayor predisposición a presentar infecciones debido a su sistema inmune inmaduro, menor cuidado del sitio quirúrgico, mayor frecuencia de infecciones postoperatorias, entre otros15–18. Dentro de la bibliografía internacional también encontramos trabajos más específicos como es el de Dubey et al.19 donde los autores analizan los factores de riesgo para infección del sitio quirúrgico en cirugías de fosa posterior. Sin embargo, dentro del análisis los autores incluyen cirugías con diferentes tasas de complicaciones que no parecen compartir los mismos riesgos, como, por ejemplo, exéresis tumoral y descompresiva para cirugía de Chiari.
Cuanto más específica sea la población estudiada y más similares sean el grupo de casos y controles en sus características basales, más preciso va a ser el análisis de factores de riesgo. Es por esto que decidimos evaluar los factores de riesgo para infección postoperatoria en las cirugías de exéresis de tumores de fosa posterior en una cohorte de pacientes pediátricos. La exéresis de tumores de fosa posterior es uno de los procedimientos más frecuentes de la neurocirugía pediátrica por lo tanto conocer los factores que promueven infecciones postoperatorias puede ser de utilidad para la comunidad neuroquirúrgica1.
Para el análisis dividimos los factores de riesgo entre prequirúrgico, intraquirúrgico y postoperatorio. Dentro de los factores prequirúrgicos encontramos que la colocación de una DVE o DVP dentro del mes previo a la cirugía, o durante la exéresis tumoral, se asocia a una mayor chance de presentar una infección en el postoperatorio. En el análisis excluimos los pacientes con infecciones asociadas directamente al sistema de DVP o DVE, sin embargo, por la naturaleza retrospectiva del trabajo no podemos excluir por completo que las infecciones posteriores a la exéresis tumoral no estén asociadas a los sistemas derivativos per sé. No obstante, los resultados obtenidos muestran que los pacientes con tumores de fosa posterior, en donde se trató la hidrocefalia con un DVE o DVP, se infectan más frecuentemente en el postoperatorio de la cirugía tumoral. No sucedió lo mismo con los pacientes a los que se les realizó una tercer ventriculostomía endoscópica (TVE) como tratamiento de la hidrocefalia. No es casualidad que a medida que aumentamos los procedimientos de TVE, disminuyeron las infecciones (Figura 7). Por lo tanto, ante la presencia de hidrocefalia prequirúrgica, el tratamiento que presentó menor riesgo de infección postoperatoria fue la TVE, de modo que en los centros en los que se cuenta con un endoscopio, este procedimiento debería ser de elección.
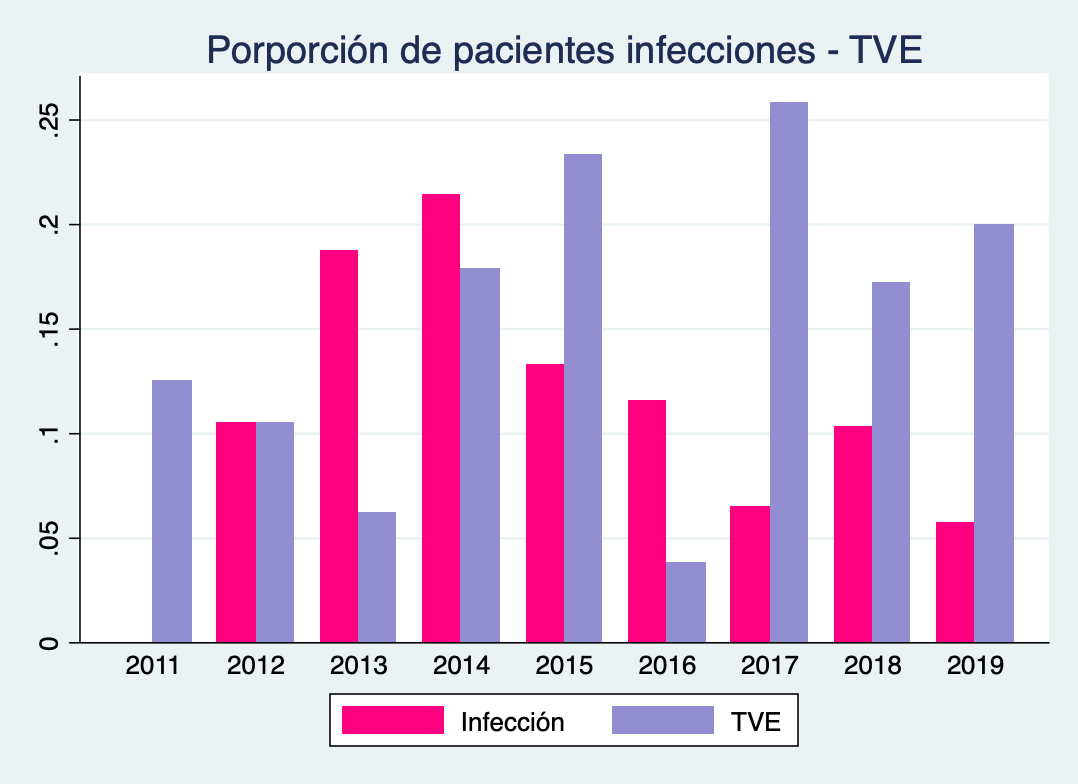
Figura 7: Proporción de infecciones y de TVE en tumores de fosa posterior
Otro factor prequirúrgico que demostró estar asociado a infección en el postoperatorio fue la hemoglobina, esta asociación se encuentra descrita en algunos trabajos20, pero aun no estaba demostrada la asociación en procedimientos neuroquirúrgicos del paciente pediátrico. No sería de mala práctica en cirugías programadas suplementar al paciente para que consiga un mejor valor de hemoglobina previo al ingreso a quirófano, o en el caso de las urgencias, se podrían considerar transfusiones de sangre preventivas, ya que en la mayoría de los casos se termina requiriendo durante el procedimiento quirúrgico.
En cuanto a los factores de riesgo intraquirúrgico encontramos que la duración de la cirugía parecería influir directamente en las chances de tener una infección en el postoperatorio. Esta asociación se encuentra descrita en varios trabajos21,22, no solo neuroquirúrgicos. Golebiowski et al.23 analizaron una cohorte de 1000 pacientes adultos donde encontraron que la duración del procedimiento neuroquirúrgico se asocia independientemente a infecciones postoperatorias. El conocimiento sobre el daño potencial de las cirugías prolongadas debería ser de interés para los neurocirujanos al momento de decidir quién realiza la cirugía y que tipo de abordaje o que herramientas quirúrgicas que se utilizarán. Existen dos factores intraquirúrgicos que no llegaron a ser estadísticamente significativos, sin embargo, demostraron cierta tendencia hacia la presencia de una infección postoperatoria. Estos son la cirugía de urgencia y el uso de microscopio. La cirugía de urgencia está asociada a infecciones postoperatorias probablemente debido a que la preparación del paciente no es la adecuada, además de que, en la urgencia, se pueden pasar por alto los controles de asepsia y antisepsia que se realizan de rutina. En cuanto al uso de microscopio esto probablemente se deba a las técnicas de colocación del cobertor o a mantener la esterilidad durante la utilización del mismo. Debido a que el microscopio, en muchos casos, es un elemento esencial durante la cirugía, es importante entrenar a los neurocirujanos en formación acerca de cómo mantener la esterilidad del mismo durante su uso.
Dentro de los factores postoperatorios encontramos que la fístula por la herida aumenta las chances de tener una infección postoperatoria. Esta asociación se encuentra descrita en las cirugías de fosa posterior desde hace varios años. Gnanalingham et al.24 encontraron una asociación muy fuerte entre fístula de LCR y craniectomía en cirugías de fosa posterior. En nuestro servicio desde antes del 2014 realizamos craneotomía con recolocación de la plaqueta ósea por lo que esta variable no influyó en nuestro análisis. No obstante, la fístula no deja de ser una complicación frecuente en todas las cirugías de fosa posterior. En nuestra cohorte no encontramos asociación entre la necesidad de una plástica dural y la incidencia de infecciones sin embargo de los 10 casos de fístula dural 7 requirieron plástica de duramadre. Al mismo tiempo se sabe que ante un cierre dural no hermético la hidrocefalia es un gran facilitador de la fístula de LCR. Por lo tanto, no es erróneo pensar que un tratamiento más agresivo de la hidrocefalia desde la presentación del paciente ayudaría a prevenir esta complicación. En nuestra institución, cuando un paciente ingresa con hidrocefalia por imágenes, pero sin clínica de hipertensión endocraneana, preferimos realizar la cirugía de exéresis tumoral como primer procedimiento. Teniendo en cuenta la baja morbi- mortalidad que tiene la TVE, y considerando que es el único procedimiento para tratar la hidrocefalia que no se asoció a infecciones, quizás sería prudente realizar una TVE como primer procedimiento en todo paciente con hidrocefalia, sin importar los síntomas. Además, el tratar la hidrocefalia previo a la cirugía tiene beneficios al momento de la exéresis tumoral, permitiendo un parénquima cerebral menos tenso con menor riesgo de lesión de las estructuras vasculo-nerviosas que rodean la lesión.
Las limitaciones de nuestro estudio radican en el diseño retrospectivo del mismo, donde no se puede establecer temporalidad entre la presencia del factor de riesgo y el evento. Sin embargo, al tratarse de un ambiente controlado, con dos poblaciones de pacientes con características muy similares disminuye los sesgos propios de un estudio de casos y controles. Al mismo tiempo, todos los pacientes fueron operados en nuestra institución por lo que, a pesar de las diferentes técnicas entre cirujanos, se siguen los mismos lineamientos en cuanto al abordaje y el cierre, que son pasos claves para prevenir complicaciones en el postoperatorio.
CONCLUSIONES
Las infecciones postoperatorias de las cirugías de exéresis de tumores de fosa posterior pueden tener consecuencias devastadoras para el paciente pediátrico.
Algunas estrategias que podrían ayudar a reducir el número de infecciones son: un adecuado control de la hidrocefalia prequirúrgica, preferentemente mediante TVE; reducir al mínimo el tiempo quirúrgico necesario para realizar el procedimiento; ingresar a quirófano con una hemoglobina adecuada y evitar la fístula de líquido por la herida.