Modelo integral de entrenamiento microquirúrgico y neuroendovascular
con placenta humana
Joaquín Pérez Zabala1, Florencia Beldi1, Alexis Tovar1, Pablo Kuchlewski1, Miguel Nuñez1, Graciela Lozano2, Laura Abojer3, Héctor Belziti1
Joaquín Pérez Zabala
joaquinperezzabala@gmail.com
Recibido: enero de 2020.
Aceptado: junio de 2020
No hay conflictos de intereses.
RESUMEN
Introducción: La neurocirugía vascular, tanto la microquirúrgica como endovascular, ha progresado significativamente en el tratamiento de la patología cerebrovascular. Sin embargo, en una considerable proporción de casos este tipo de patología no puede ser resuelta definitivamente mediante un único abordaje. Por lo cual consideramos que el neurocirujano en formación debe capacitarse con ambas técnicas.
Se describe un modelo de entrenamiento en microcirugía y en nociones básicas del material y técnica neuroendovascular, utilizando placenta humana y recursos de baja complejidad.
Material y método: Se utilizaron 20 placentas humanas, instrumental y sutura de uso habitual en microcirugía, microscopio quirúrgico Newton®XX1, material para procedimientos endovasculares; equipo de radioscopia (arco en C Phillips BV Pulsera®), un cráneo óseo y un cabezal de fijación tipo Sugita® adaptado a su uso en laboratorio. Los ejercicios consistieron en: 1. Disección y exposición de los vasos arteriales y venosos del corion; 2. Anastomosis término-terminal, termino-lateral y latero-lateral; 3. Generación de aneurismas laterales, de bifurcación o trifurcación; 4. Creación de bypass extra-intracraneano; 5. Clipado de los aneurismas en superficie y dentro del cráneo; 6. Control angiográfico pre y post clipado. 7. Embolización con coils de los aneurismas experimentales y de vasos placentarios con partículas de Spongostan®.
Resultados: Aunque los vasos tienen una estructura y consistencia diferentes a los habituales para el neurocirujano, la placenta ofrece una variabilidad de calibres y formatos donde practicar los diferentes ejercicios.
Conclusión: El entrenamiento en técnicas microquirúrgicas y neurointervencionistas puede ser realizado en modelos placentarios de simulación, que permiten el desarrollo háptico progresivo previo a la realización de un procedimiento in vivo.
Palabras clave: Microcirugía; Modelo de Entrenamiento; Neurointervencionismo Endovascular; Placenta Humana; Simulación.
ABSTRACT
Objective: Describe a training model in microsurgery and neuroendovascular surgery, using human placenta and low complexity resources.
Material and methods: 20 human placentas, instruments and sutures were used in microsurgery, Newton XX1 surgical microscope, material for endovascular procedures; radioscopy equipment (C-arch Phillips BV Pulsera), a bony skull and a Sugita head adapted for laboratory use. The exercises consisted of: 1. Dissection and exposure of the arterial and venous vessels of the chorion; 2. End-to-end, end-to-side, side-to-side anastomosis; 3. Generation of lateral, bifurcation or trifurcation aneurysms; 4. Creation of extra-intracranial bypass; 5. Clipping of aneurysms on the surface and inside the skull; 6. Pre and post clipping angiographic control. 7. Coil embolization of experimental aneurysms and placental vessels embolization with spongostan particles.
Results: Although the vessels have a different structure and consistency than usual for the neurosurgeon, the placenta offers a variability of sizes and formats to practice the different exercises.
Conclusion: Training in microsurgical and neurointerventionist techniques can be carried out in placental models, which allow progressive haptic development prior to performing an in vivo procedure.
Key Words: Endovascular Neurosurgery; Human Placenta; Microsurgery; Simulation; Training Model
“...Surgery is and must be always an art, but its progress and thus its vitality depend on the maximum application to it of the methods...”
Hugh Cairns, 1926
INTRODUCCIÓN
Los procedimientos microquirúrgicos y endovasculares en el Sistema Nervioso Central tomaron relevancia progresiva en el tratamiento de la patología vascular, y se han transformado en prácticas de rutina. Por ello, existe una necesidad creciente de entrenar al neurocirujano en ambas disciplinas.
Parte del entrenamiento incluye una etapa de creación de aneurismas que luego deberán ser cateterizados o clipados por abordaje directo, así como el reemplazo de sectores vasculares en riego, o dañados mediante la confección de bypass con o sin injerto.
Si bien existen modelos animales, estos presentan limitaciones y necesidad de infraestructura de mayor complejidad. Esto dificulta la formación y, posteriormente, la reproducción de las técnicas. Así es como surge la necesidad de utilizar tejidos complejos con abundancia de vasos y mayor accesibilidad. La placenta es vista últimamente, como un órgano que ofrece estas características en una institución que cuente con un servicio de obstetricia.
El objetivo de este trabajo fue describir a la placenta humana como un órgano útil para el entrenamiento en microcirugía y la adquisición de las nociones del manejo neuroendovascular mediante la ilustración de ejercicios de creciente complejidad.
MATERIAL Y MÉTODO
Descripción del instrumental y/o técnica
Previa aprobación por el Comité de Ética y Docencia, servicio de Anatomía Patológica y servicio de Ginecología y Obstetricia se dispuso de 20 placentas humanas que fueron utilizadas para la realización de procedimientos microquirúrgicos y endovasculares. Se firmó un consentimiento informado materno. Todas ellas fueron obtenidas de embarazos controlados y con pruebas de laboratorio infectológico negativas.
Placenta humana
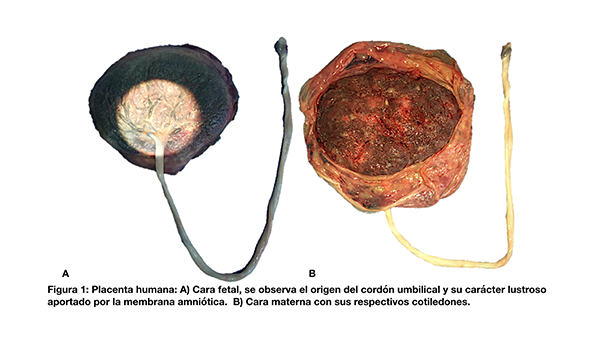
La placenta humana (del latín torta plana) es un órgano endocrino discoide de carácter transitorio. Pesa 470 g aproximadamente y posee un diámetro de 22 cm y un espesor central de 2,5 cm.1,2 Presenta dos caras. Macroscópicamente se reconoce la cara fetal por ser lustrosa, característica que surge de la aposición de la membrana amniótica y la visualización del cordón umbilical (fig. 1A). La cara materna puede o no presentar tabiques y cotiledones (fig. 1B).3 Las estructuras vasculares tienen una extensión promedio de 87 cm.4 El espesor arterial promedio es de 2.6-5.9 mm y el venoso de 4.2-10.2 mm.5 El cordón umbilical posee dos arterias y una vena central. En su extensión aproximada de 50 cm se pueden apreciar pseudonudos generados por la presión del flujo circulatorio.
Desde el punto de vista macroscópico los vasos placentarios poseen un diámetro global mayor y una pared de menor diámetro que los cerebrales (fig. 2A). Estos últimos poseen una pared relativamente fina ya que se encuentran dentro del cráneo resguardados de las presiones y estiramientos exteriores. Mediante técnicas de microscopía óptica (H-E, fibras elásticas) se constata una elástica interna bien desarrollada a diferencia de la túnica media (fig. 2 B-C). Los vasos placentarios prácticamente no poseen elástica interna y por otro lado no presentan marcadores histológicos que permitan la diferenciación entre arterias y venas (fig. 2 D-E). Una de las explicaciones de este fenómeno es que la determinación de convertirse en un vaso arterial o venoso es dependiente de la exposición a la presión sanguinea.6
Para la realización del entrenamiento microvascular se utilizó:
Ejercicio microvascular
1. Placenta humana 18.
2. Microscopio quirúrgico (serie XXI, newton®).
3. Lupas quirúrgicas 2,5 x.
4. Instrumental microquirúrgico (porta agujas de micro recto y curvo, micro tijera recta y curva, pinza de micro, pinza relojero n°5).
5. Cabezal de fijación craneal (sugita®).
6. Equipo bipolar.
7. Equipo de aspiración (compresor pendular, 100 lts, tausem®).
8. Clip vascular (recto, curvo, fenestrado l 11mm, yasargil).
9. Sutura prolene 6-0, nylon 8-0, 9-0, 10-0.
10. Sonda foley 6f.
11. Sonda nasogástrica 5f.
12. Catéter fogarthy 5f.
13. Jeringa 1 ml, 5 ml, 60 ml.
14. Abocath 16, 18, 20 g.
15. Heparina (sódica 5000 ui/ml).
16. Algodón.
17. Lámina de goma (tipo smarch).
18. Tinta china azul, roja, tempera azul, roja.
19. Refrigeración 6-24 hs (4-10°c).
Se utilizó el siguiente material para la realización del entrenamiento endovascular:
Ejercicio neurointervencionismo
1. Placenta humana 7.
2. Equipo radioscopia arco en c (Phillips bv pulsera®).
3. Chalecos plomados (Mks®).
4. Guía de suero macro gotero sin aguja b-14 (Braun®).
5. Solución fisiológica.
6. Ringer lactato.
7. Heparina (2500 ui/100 m).
8. Lino (n°60).
9. Abocath (16, 18, 20g).
10. Medio de contraste (iopamidol radiológico no iónico 300mg de iodo/ml, opacrile 300®).
11. Introductor 5f (femoral, prelude®).
12. Catéter vertebral 5f (penumbra, select®).
13. Catéter guía 6f (guider soft tip, stryker neurovascular®).
14. Microguía 0,014 (trandsend ex, stryker neurovascular®).
15. Microcateter (excelsior sl10, stryker neurovascular®).
16. Coils (helicoidal, 3d, 360°, stryker neurovascular®).
17. Esponja gelatinosa hemostática reabsorbible (7x5x1 cm, spongostan®).
18. Llaves lambda/y.
19. Presurizador (500ml, meritmedical®).
20. Bomba de infusión continua (activa a 22, adox®).
Ejercicio inicial
1-Lavado y disección de vasos
A 20 placentas humanas se les removió cuidadosamente los remanentes de la bolsa amniótica y la membrana corioalantoidea de la cara fetal para una mejor exposición y visualización de los vasos placentarios. Se seccionó el cordón umbilical a 5 cm de su origen, para permitir la cateterización de las arterias y de la vena umbilical. Luego se realizó el lavado de la placenta a través de la conexión de un sistema presurizado a los vasos cordonales, constituido por un Baxter con solución fisiológica adicionada con 1 ml de heparina sódica.4,7
Se realizó disección roma y filosa de vasos placentarios con instrumental microquirúrgico bajo microscopia óptica (fig. 3 A-B-E). Se constató la diferencia en la disposición vascular placentaria respecto a las estructuras vasculares cerebrales (fig. 3 C-D).
2-Arteriotomía y sutura longitudinal
Incisión longitudinal de 1 cm y sutura con puntos continuos y discontinuos.
3- Anastomosis termino-terminal, latero-lateral y latero-terminal de vasos placentarios
Previa disección del plano, se realiza sección transversal completa del vaso y sutura de sus cabos según técnica de triangulación de Carrel que consiste en suturar tres puntos que sirven de tracción, a intervalos de un tercio de la circunferencia. Es aconsejable comenzar por la cara posterior y dejar uno de ellos más largo para facilitar la tracción.6 Para algunos de los ejercicios se utilizó sutura continua.
Ejercicios avanzados
1-Generación de aneurisma y clipado
Para realizar aneurismas laterales, de bifurcación y trifurcación vascular se disecaron los vasos seleccionados y se realizaron dos puntos de ligadura y sección entre ambos (fig. 4 A-B-C). Los diversos tamaños aneurismáticos se confeccionaron longitudinalmente utilizando distintas distancias entre las ligaduras desde el cuello al domo. Para generar cambios en el ecuador aneurismático se utilizó el insuflado continuo de balón del catéter Fogarthy. Se realiza un primer control angiográfico donde se verifica la morfología, tamaño y disposición aneurismática (fig. 4 D).
I-Aneurisma de trifurcación: Generación - clipado - control angiográfico.
Se continua con la secuencia del clipado aneurismático realizando disección filosa de ambas axilas y el clipado del mismo (fig. 5 A-B-C). Se realiza posterior control angiográfico verificando la ausencia de relleno del saco aneurismático y la posición adecuada del clip (fig. 5 D-E).
2-Disección entre placentas aposicionadas
Realizado el ejercicio previo, se rota una placenta sobre sí misma y se realiza disección desde la cara contralateral (materna) hasta localización y clipado del aneurisma. De esta manera se logra simular la disección en profundidad. Se realiza la misma actividad con el mismo objetivo, superponiendo una placenta con otra.
3-Posicionamiento de placenta en el cráneo
Se realiza una craneotomía pterional y se repite el mismo ejercicio de clipado en profundidad con microscopio quirúrgico o lupas de magnificación.
II- Aneurisma lateral intracraneal: Generación - clipado - control angiográfico.
Se selecciona el segmento vascular para el diseño del aneurisma (fig. 6 A-B). Se procede a la disección y sección del amnios para la preparación del aneurisma subyacente (fig. 6 C). Se debe lograr un buen plano de disección vascular para poder realizar el pasaje de un hilo de sutura (nylon 8-0) y la ligadura distal (fig. 6D-E-F).
El posicionamiento de la placenta en el cráneo permite un mayor adiestramiento, aproximando el ejercicio a un escenario más realista. La postura del cirujano, la posición del modelo y el necesario respeto por las distancias focales adecuadas, son las exigencias básicas que el ejercicio demanda para poder llevar a cabo la resolución del mismo (fig. 7 A). Se realiza la disección proximal del vaso que va a dar origen al aneurisma. Luego se practica una nueva ligadura como fue descripto previamente y se secciona entre ambos puntos, dejando la porción distal aislada y la conformación proximal del aneurisma (fig. 7 B-C).
Se practica la apertura amniótica mediante disección filosa inicial y roma subsiguiente (fig. 7D). Se comienza la disección de la axila proximal (fig. 7 E) y se prosigue con la distal posicionando una banda de goma por debajo del aneurisma (fig. 7 F). Tras observar la ruptura accidental del aneurisma se realiza un clipado aneurismático transitorio (fig. 7 G-H). El modelo permite la posibilidad de intentar clipados alternativos (fig. 7 I).
Se realiza un cateterismo placentario del vaso arterial madre del cordón umbilical mediante un catéter guía 6F fijado con una ligadura de lino n°60. Se procede a la inyección de contraste iodado diluido al 70% donde se observa la conformación vascular arterial y el aneurisma con la respectiva fuga de contraste (fig. 8 A). El cateterismo permite verificar un clipado aneurismático inadecuado, con un cuello remanente (fig. 8 B) y su corrección (fig. 8 C-D).
III-Aneurismas múltiples: bifurcación distal y transposición venosa: Generación - clipado intracraneal en profundidad - control angiográfico.
Para confeccionar aneurismas por transposición, se seleccionaron segmentos de vasos tanto venosos como arteriales (fig. 9 A-B). Para la generación de un aneurisma de bifurcación distal, se selecciona un segmento vascular (fig. 9 C). Luego se realiza disección filosa con micro tijera curva y posteriormente se hace el pasaje de sutura infra vascular con nylon 8-0 (fig. 9 D). Se practica ligadura proximal y se realiza un nuevo pasaje de sutura, tras lo cual se efectúa la ligadura distal y finalmente la sección con micro tijera entre ambas ligaduras (fig. 9 E-F).
Se selecciona un segmento venoso para la conformación del aneurisma de transposición (fig. 10 A). Se practica una disección filosa infra vascular evitando transgredir el plano o lesionar el injerto vascular, se realiza el pasaje de sutura nylon 8-0 (fig. 10 B). Se efectúa una ligadura proximal y un nuevo pasaje de sutura distal (fig. 10 C). Se realiza la ligadura distal y otra intermedia próxima a la primera ligadura (fig. 10 D). Primero se secciona en forma oblicua el injerto próximo a la ligadura distal y se hepariniza con jeringa de 1 ml (fig. 10 E). Luego se secciona con micro tijera entre la ligadura proximal y la intermedia, conformando el aneurisma (fig. 10 F-G). Tras marcar el vaso receptor con tinta china, se realiza una arteriotomía en “boca de pez” con micro tijera curva y se sutura con nylon 10-0 mediante puntos discontinuos utilizando técnica de Carrel (fig. 10 H-I).
Se posiciona la placenta con los aneurismas generados dentro del cráneo (fig. 11 A). Se realiza un cateterismo selectivo placentario como fue descripto previamente, donde se visualiza la localización aneurismática y los sitios de fuga de contraste (fig. 11 B). Se practica la apertura de la membrana amniótica y se procede a la disección en profundidad (fig. 11 C-D). Se identifica el aneurisma de bifurcación, se diseca la axila proximal, la distal y se coloca un clip recto de 7 mm (fig. 11 E-F). Se identifica el aneurisma de transposición y se diseca la axila proximal y la distal (fig. 11 G-H).
Se coloca un clip fenestrado de 90° sobre el cuello del aneurisma de transposición (fig. 12 A). Se realiza un cateterismo que evidencia la correcta colocación de los clips, sin cuello remanente y un adecuado flujo distal (fig. 12 B-C).
4-Generación de bypass
Se selecciona un vaso receptor en la placenta para el bypass (fig. 13 A). Se posiciona la placenta en el cráneo y se fija mediante cabezal de Sugita (fig. 13 B). Se selecciona un segmento de 8 cm de longitud del cordón umbilical (fig. 13 C). Se diseca la gelatina de Wharton del cordón umbilical hasta encontrar una de las arterias umbilicales (fig. 13 D). Se continua con la disección en forma centrífuga hasta obtener una longitud final de 6 cm (fig. 13 E-F).
IV-Bypass extra-intracraneano: Generación - control angiográfico
Se secciona el segmento arterial disecado del cordón umbilical, en forma oblicua en un extremo y en forma recta en el otro. Este último se liga a un abocath n° 22 con lino n° 60 (fig. 14 A). Se realiza disección del vaso receptor, ligadura proximal con prolene 6-0 y una arteriotomía en “boca de pez” con micro tijera curva (fig. 14 B). Finalmente se practica una sutura con puntos discontinuos anastomosando el vaso dador con el vaso receptor (fig. 14 C-D).
Para comprobar la permeabilidad del bypass se realiza un control angiográfico inyectando contraste diluido al 70% (fig. 15 A). Esto permite verificar el correcto relleno del árbol vascular distal (fig. 15 B).
NEUROINTERVENCIONISMO
1-Angiografía común para reconocimiento de elementos básicos.
2-Cateterización de vasos placentarios.
3-Avance guiado por radioscopia y road mapping.
4-Manejo de catéter guía, microcatéter y microguía.
5-Embolización con coils de aneurisma placentario.
6-Embolización con spongostan de vasos placentarios distales.
Se creó un dispositivo de soporte con una inclinación de 45° para el posicionamiento de la placenta durante la realización de los procedimientos angiográficos (fig. 16 A-B). De esta manera se optimizó la visualización de las estructuras vasculares contrastadas y el manejo de los catéteres de neurointervencionismo debido al lavado constante por efecto gravitatorio del contraste remanente hacia una bolsa colectora roja descartable que queda fuera del campo de visión radioscópica (fig. 16 C).
Ejercicios de neurointervencionismo
I-Aneurisma lateral y aneurisma de bifurcación proximal: Generación y control angiográfico.
Se seleccionan distintos territorios arteriales de la placenta para la generación de un aneurisma lateral y otro de bifurcación (fig. 17 A-B). Se diseca la membrana amniótica con micro tijera (fig. 17 C). Se diseca en forma filosa la cara lateral vascular y se prosigue con la región infra vascular (fig. 17 D-E). Se practica una ligadura con nylon 8-0 conformando así el aneurisma lateral (fig. 17 F-G-H).
Para la generación del aneurisma de bifurcación se diseca la cara lateral de uno de los vasos seleccionados (fig. 18 A). Se realiza el pasaje de sutura por debajo del mismo (fig. 18 B). Se practica una ligadura con nylon 8-0 (fig. 18 C). Luego se cateterizan los vasos arteriales mediante catéter guía 6F y se inyecta contraste diluido al 70% lo que permite observar la morfología, disposición y el tamaño aneurismático (fig. 18 D-E).
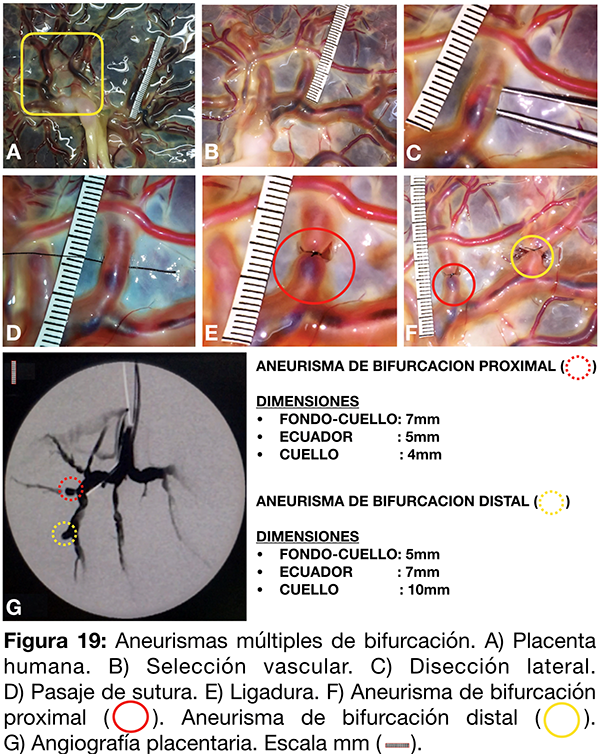
II-Aneurismas múltiples de bifurcación: Generación y control angiográfico.
Se selecciona un territorio arterial de la placenta para la generación de múltiples aneurismas de bifurcación (fig. 19 A-B). Tras disecar la membrana amniótica con micro tijera, se disecan en forma filosa las caras laterales vasculares y se prosigue con la región infra vascular (fig. 19 C). Se practican ligaduras con nylon 8-0 conformando los aneurismas de bifurcación proximal y distal (fig. 19 D-E-F). Finalmente se cateterizan los vasos arteriales mediante catéter guía 6F y se inyecta contraste diluido al 70% (fig. 19 G).
III- Aneurisma sacular: Generación y embolización con coils.
Se selecciona un vaso arterial de la placenta para la generación de un aneurisma sacular (fig. 20 A). Tras disecar la membrana amniótica con micro tijera, se diseca en forma filosa la cara lateral vascular, se continua con la región infra vascular y se practican dos ligaduras con nylon 8-0. Luego se secciona el vaso con micro tijera recta entre ambos puntos conformando el aneurisma sacular (fig. 20 B). A continuación, se cateterizan los vasos arteriales mediante catéter guía 6F y se inyecta contraste diluido al 70% (fig. 20 C-D).
Se introduce a través del catéter guía (el cual se encuentra conectado a un lavado presurizado mediante conector en “Y” o llave lambda) un microcatéter el cual se avanza sobre microguía (también conectados a lavado presurizado) y se navega bajo control radioscópico hasta la visualización del marker proximal y distal (fig. 21 A). Se realiza una inyección de contraste al 70% y se utiliza para la generación del “road mapping” (imagen negativa vascular donde se observa la progresión del catéter). Una vez alcanzado el interior del saco aneurismático con el marker distal del microcatéter se retira la microguía y se avanza el coil para comenzar a generar el cast (canasta) (fig. 21 B). Para el cálculo aproximado del tamaño del coil se realiza la sumatoria de las longitudes de fondo-cuello y del ecuador (mayor diámetro a lo ancho del aneurisma) y se divide el resultado a la mitad. Esto orienta al tamaño que deberá tener la espira del coil. Se prosigue con la embolización progresiva del aneurisma (fig. 21 C-D-E). Finalmente se observa en forma directa la disposición del coil dentro del aneurisma (fig. 21 F).
IV- Embolización de ramo distal con spongostan.
Se cateteriza un vaso arterial placentario con un catéter guía 6F y se inyecta contraste diluido al 70% (fig. 22 A). Se realiza un mapa seco (road mapping sin inyección de contraste previa) y se embolizan desde el catéter guía en forma progresiva los ramos distales utilizando Spongostan® fragmentado en una jeringa de 5ml con contraste al 50% (fig. 22 B-C). Finalmente se observa en forma directa el material de embolización intraarterial (fig. 22 D).
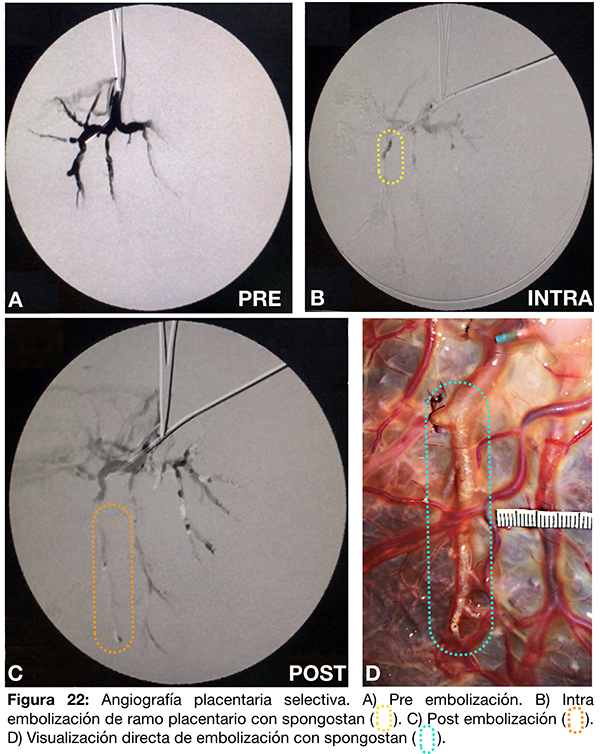
Figura 22: Angiografía placentaria selectiva. A) Pre embolización. B) Intra embolización de ramo placentario con spongostan (![]() ). C) Post embolización (
). C) Post embolización (![]() ). D) Visualización directa de embolización con spongostan (
). D) Visualización directa de embolización con spongostan (![]() ).
).
RESULTADOS
De un total de 20 placentas humanas, 18 se pudieron utilizar para realizar ejercicios de microcirugía (dos fueron descartadas por lesiones en cordón umbilical y de la cara fetal). Se realizaron ejercicios de disección microquirúrgica de estructuras vasculares, anastomosis latero-lateral, latero-terminal y término-terminales. Se generaron aneurismas de bifurcación, de trifurcación, terminales, laterales y de transposición mediante injerto venoso o arterial.
Mediante la utilización de una bomba de infusión continua se pudo simular la pulsatilidad del flujo sanguíneo para mayor representatividad del escenario quirúrgico y practicar clipado aneurismático con y sin ruptura.9,10 El posicionamiento de la placenta en cráneo y fijación con cabezal Sugita® permite la apertura amniótica mediante el microscopio quirúrgico como ejercicio de disección silviana. A su vez el trabajo en profundidad, utilizando la pinza bipolar y la aspiración continua para la inspección, disección y clipado de los aneurismas generados, reproduce en forma realista el manejo de la patología aneurismática.7,11
Se diseñó un bypass extra-intracraneano seccionando un vaso arterial del cordón umbilical obtenido por disección filosa. Posteriormente, se suturó a una placenta posicionada en cráneo.
Los procedimientos endovasculares se pudieron realizar en 7 placentas. Se practicó embolización con coils (sin liberación) en 5 placentas y liberación de partículas de Spongostan® en 2 de ellas.
DISCUSIÓN
Reseña histórica
En 1979, Goldstein planteó el uso de placentas humanas para el entrenamiento microquirúrgico como valioso complemento al laboratorio con modelo animal.12 En publicaciones posteriores se propuso el modelo placentario para múltiples especialidades.10 En 2013, J.K Kwok empleó el modelo placentario para práctica neurovascular, describiendo trombólisis, embolización con Onyx® y liberación de diversores de flujo.9 Posteriormente, en 2014, Oliveira describió la utilización del modelo placentario para la realización de aneurismas.7
La evolución del tratamiento endovascular en la patología del sistema nervioso central ha llevado a la necesidad de crear medios adecuados para la práctica. Esto sumado a la preparación en técnicas de microcirugía vascular forma parte del entrenamiento del neurocirujano en formación. En nuestro medio en el que la carencia de recursos e infraestructura hace difícil este proceso, la introducción de un modelo de trabajo y entrenamiento micro y endovascular factible, con el uso de placentas humanas, material de rutina de cateterismo y guía radioscópica no compleja, permite obtener un modelo con resultados reproducibles de una práctica a la siguiente, y en consecuencia, un aumento y mejoría en la praxia de aquellos que la realizan acompañado de un adecuado marco teórico.13-15
Modelo placentario
Dentro de las ventajas se debe destacar que es un modelo biológico de significativa disponibilidad que no implica un costo para el sistema sanitario y que es de fácil conservación. Si bien los vasos placentarios constan de diámetros promedio mayores a los vasos cerebrales presentan múltiples oportunidades de ejercicios para la práctica con un solo modelo (vasos placentarios: arteriales 2.6 - 5.9 mm; vasos placentarios venosos: 4.2 - 10.2 mm vs. vasos cerebrales: arteria cerebral anterior: 1.0 - 3.0 mm; arteria cerebral media: 2.4 - 4.6 mm; arteria vertebral: 0.92 - 4.09 mm; arteria cerebral posterior: 0.65 - 1.78 mm; arteria cerebelosa posteroinferior: 0.65 - 1.78 mm).4,17 Su amplia versatilidad permite generar ejercicios simples como disección microvascular, arteriotomía con sutura longitudinal y anastomosis o de práctica avanzada ya sean aneurismas o bypass.
Respecto a las desventajas se debe mencionar que es un modelo no vivo, y esto no permite la absoluta similitud respecto a los factores fisiológicos, como ser las características hemodinámicas del flujo sanguíneo, las alteraciones fisiopatológicas que devienen de la intervención del cirujano como el vasoespasmo e inclusive la aplicación de las técnicas descriptas por Acland para evitarlo, los fenómenos que participan en la cascada de coagulación y el ulterior proceso de cicatrización endotelial.17-19 Como modelo de investigación para la generación de aneurismas presenta un valor limitado ya que no permite evaluar el crecimiento de los mismos a través del tiempo impulsado por factores hemodinámicos activos.20-22 A su vez el hecho de ser un modelo orgánico acarrea el inconveniente de su deterioro estructural.
“El mapa no es el territorio.”
Alfred Korzybski, 1931
Creemos que este modelo es útil para la praxia microquirúrgica y endovascular, pero no reemplaza las prácticas en modelo vivo y, mucho menos, la cirugía en la progresiva formación neuroquirúrgica. Es un complemento, uno de los tantos requeridos, para una cirugía efectiva.23
La información que nos deja esta experiencia no es cuantitativa sino cualitativa y morfológica. La manipulación microquirúrgica y la endovascular con sus problemas técnicos básicos y el acceso a la visualización directa del comportamiento de un coil dentro de un aneurisma o de la embolización con partículas convierten la experiencia en altamente útil para aprender las nociones sobre el manejo y cuidado de catéteres y coils dentro y fuera del paciente: conocimiento práctico alcanzable únicamente a través del uso. El presente trabajo es fruto de una larga trayectoria de nuestro servicio en el estudio y la realización de aneurismas experimentales.24
La microscopía quirúrgica y la técnica microquirúrgica son herramientas establecidas e indispensables en la práctica neuroquirúrgica. La simulación quirúrgica alcanzada mediante el posicionamiento del modelo con el cabezal Sugita®, el respeto por las distancias focales y el adiestramiento de las maniobras quirúrgicas en profundidad, tienen una considerable ventaja que supera inclusive la mayoría de los modelos vivos más frecuentemente utilizados.
Las técnicas neuroendovasculares evolucionaron considerablemente mediante el desarrollo tecnológico, la menor invasividad (o mejor dicho mínimo acceso) en el contexto de patología vascular en curso, permitiendo mejores resultados que distan de ser los óptimos en una enfermedad tan devastadora como lo es la patología cerebrovascular (aneurismas, malformaciones, fístulas durales, etc.). Esto ha llevado a una mayor resolución de la patología aneurismática en forma endovascular, reflejada en artículos de referencia que, sin embargo, no han logrado escapar a la controversia (ISAT, BRAT).25,26 Por otro lado, a una menor exposición de los neurocirujanos en formación al abordaje quirúrgico a cielo abierto.27,28
En una considerable proporción de casos este tipo de patología no puede ser resuelta definitivamente mediante un único abordaje.29 Creemos que el neurocirujano en formación debe capacitarse con ambas técnicas. Ser capaz de resolver la patología cerebrovascular mediante un profundo conocimiento y manejo de la anatomía normal, sus variantes y la fisiopatología de la circulación cerebral considerando la individualización en cada caso.
La técnica microquirúrgica requiere un entrenamiento dedicado, comprometido y progresivo. El manejo neuroendovascular demanda preparación, práctica y competencia. Estas características transforman a la microcirugía y al manejo endovascular en disciplinas que deben ser asimiladas por el neurocirujano en formación.
CONCLUSIÓN
El entrenamiento en técnicas microquirúrgicas y neurointervencionistas puede ser realizado en modelos placentarios de simulación que permiten el desarrollo háptico progresivo previo a la realización de un procedimiento in vivo.
BIBLIOGRAFÍA
1. Aboud E, Aboud G, Al-Mefty O, Aboud T, Rammos S, Abolfotoh M, Hsu SP, Koga S, Arthur A, Krisht A. "Live cadavers" for training in the management of intraoperative aneurysmal rupture. J Neurosurg. 2015 Nov;123(5):1339-46.
2. Acland RD. Symposium of microsurgery. New York. Ed Daniller Avron y Strauch Berish. 1976.
3. Ayoubi, Samer, Ward, Peter, Naik, Sunil, Sankaran, Mohanan. The Use of Placenta in a Microvascular Exercise
Technical Note. Neurosurgery. 1992 ; 30 (2) 252-254.
4. Benirschke K, Burton GJ, Baergen R. Pathology of the Human Placenta, 6th ed. New York, Springer, 2012, p 908
.
5. Burkhardt JK, Lawton MT. Training Young Neurosurgeons in Open Microsurgical Aneurysm Treatment. World Neurosurg. 2017 Jul;103:919-920.
6. Carrel A. La technique opératoire des anastomoses vasculaires et la transplantation des viscères. Lyon médical . 1902. 98: 859-864.
Cross JC. How to make a placenta: mechanisms of trophoblast cell differentiation in mice - a review. Placenta. 2005 Apr;26 Suppl A:S3-9.
7. Cross JC. How to make a placenta: mechanisms of trophoblast cell differentiation in mice - a review. Placenta. 2005 Apr;26 Suppl A:S3-9.
8. Dawson DL, Meyer J, Lee ES, Pevec WC. Training with simulation improves residents endovascular procedure skills. J Vasc Surg. 2007 Jan;45(1):149-54.
9. Fontana H, Belziti H, , Requejo F. Aneurismas experimentales. Rey Arg Neurocir 14: 21, 2000.
10. Forrest MD, O'Reilly GV: Production of experimental aneurysms at a surgically created arterial bifurcation. AJNR 10: 400-402, 1989.
11. German WJ, Black SP. Experimental production of carotid aneurysms. N Engl J Med. 1954 Jan 21;250(3):104-6.
12. Goldstein M. Use of fresh human placenta for microsurgical training. J Microsurg. 1979 Jul-Aug;1(1):70-1.
13. Kaufmann P. Basic morphology of the fetal and maternal circuits in the human placenta. Contrib Gynecol Obstet. 1985;13:5-17
14. Kurt Benirschke. Remarkable placenta. Clin. Anat. 11:194–205, 1998.
15. Kwok JCK, Huang W, Leung W, et al. Human placenta as an ex vivo vascular model for neurointerventional research. J NeuroInterv Surg. 2014;6:394-399.
16. Lawton MT. Seven bypasses. Tenets and techniques for revascularization. New York, Thieme, 2018, p 51.
17. Lehecka M, Aki Laakso A, Hernesniemi J. Helsinki Microneurosurgery Basics and Tricks. 1st Edition. Helsinki,Finland.2013.
18. McGregor JC, Wyllie FJ, Grigor KM. Some anatomical observations on the human placenta as applied to microvascular surgical practice. Br J Plast Surg. 1983 Jul;36(3):387-91.
19. Molyneux AJ, Kerr RS, Yu LM, Clarke M, Sneade M, Yarnold JA, Sandercock P; International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet. 2005 Sep 3-9;366(9488):809-17.
20. Olabe J, Sancho V. Human cadaver brain infusion model for neurosurgical training. Surg Neurol. 2009 Dec;72(6):700-2.
21. Oliveira Magaldi M, Nicolato A, Godinho JV, Santos M, Prosdocimi A, Malheiros JA, Lei T, Belykh E, Almefty RO, Almefty KK, Preul MC, Spetzler RF, Nakaji P. Human placenta aneurysm model for training neurosurgeons in vascular microsurgery. Neurosurgery. 2014 Dec;10 Suppl.
22. Oliveira Magaldi M, Ferrarez CE, Ramos TM, Malheiros JA, Nicolato A, Machado CJ, Ferreira MT, de Oliveira FB, de Sousa CFPM, Costa PHV, Gusmao S, Lanzino G, Maestro RD. Learning brain aneurysm microsurgical skills in a human placenta model: predictive validity. J Neurosurg. 2018 Mar;128(3):846-852.
23. Piazza M, Nayak N, Ali Z, Heuer G, Sanborn M, Stein S, Schuster J, Grady MS, Malhotra NR. Trends in Resident Operative Teaching Opportunities for Treatment of Intracranial Aneurysms. World Neurosurg. 2017 Jul;103:194-200.
24. Roach MR. An experimental study of the production and time course of poststenotic dilatation in the femoral and carotid arteries of adult dogs. Circ Res. 1963 Dec;13:537-51.
25. See KW, Chui KH, Chan WH, Wong KC, Chan YC. Evidence for Endovascular Simulation Training: A Systematic Review. Eur J Vasc Endovasc Surg. 2016 Mar;51(3):441-51.
26. Spetzler RF, Zabramski JM, McDougall CG, Albuquerque FC, Hills NK, Wallace RC, Nakaji P. Analysis of sacular aneurysms in the Barrow Ruptured Aneurysm Trial. J Neurosurg. 2018 Jan;128(1):120-125.
27. Waterhouse N, Moss AL, Townsend PL. The development of a dynamic model for microvascular research and practice using human placenta: a preliminary report. Br J Plast Surg. 1985 Jul;38(3):389-93.
28. Yasargil MG. Microneurosurgery IVB. Laboratory training. New York, Thieme. 1996, p 28.
29. Yasargil MG. Microsurgery I. Operative anatomy. New York, Thieme. 1984, pp 72-134.
COMENTARIO
Los autores, a través de este artículo, presentan un interesante trabajo sobre el entrenamiento microquirúrgico y neuroendovascular con placenta humana, información que es de mucha relevancia durante la etapa de entrenamiento, ya que cada vez se postula más el concepto del neurocirujano hibrido.
Se plantea de forma correcta porque se prefiere la utilización de placentas humanas, con previo consentimiento de las madres, sobre el modelo animal por limitaciones previamente descritas en el artículo, y nos recuerda la importancia del entrenamiento en laboratorio, lugar donde se deben desarrollar correctamente las técnicas quirúrgicas, así como el adiestramiento personal.
Cuenta con una descripción muy detallada de todos los materiales utilizados para el ejercicio microvascular/ endovascular que servirá de ayuda para la fácil compresión del lector y su reproducibilidad.
Las imágenes son claras, fáciles de entender, además de tener muy buena calidad visual.
A pesar de ser un tema con mucha controversia, personalmente realizo casos de cirugía endovascular y microcirugía, estoy plenamente de acuerdo que tener conocimiento de las patologías vasculares, así como de sus múltiples opciones de tratamiento, permite tener mejor resultados, ya que nos permite rescatar lo mejor de las dos técnicas que no deben competir sino complementarse. Por eso es aconsejable que el cirujano en formación debe contar con una preparación diversa para poder realizar la técnica que se ajuste más a las necesidades de la patología, y recordar que el sitio idóneo para ganar esta habilidad es el laboratorio con modelos específicos para cada patología.
En general, es un trabajo completo sobre el tema expuesto, de gran ayuda para el neurocirujano en formación y para el neurocirujano ya formado, que siempre debe estar en continuo entrenamiento.
Jimmy Achi Arteaga
Hospital Clínica Kennedy. Guayaquil, Ecuador.
COMENTARIO
En este artículo los autores presentan un modelo de entrenamiento microquirúrgico y neuroendovascular basado en la utilización de placentas humanas. Para esto utilizaron 20 placentas obtenidas de embarazos controlados con pruebas de laboratorio infectologico negativas y luego de haber obtenido un consentimiento informado por parte de las mamás.
De las 20 placentas, 18 se utilizaron para realizar ejercicios de prácticas microquirúrgicas y 7 reutilizadas para ejercicios de prácticas neuroendovasculares. Cada grupo de ejercicios contó con sus recursos específicos. Para los ejercicios microquirúrgicos se utilizaron un microscopio, instrumentos microquirúrgicos, una bomba de infusión continua para simular la pulsatilidad del flujo sanguíneo y un cráneo cadavérico seco fijado a un cabezal de Sugita para simular las condiciones quirúrgicas. Para los ejercicios endovasculares se utilizaron un equipo radioscópico de arco en C, material específico para estudios y tratamientos neuroendovasculares y, con la finalidad de simular con mayor realidad las condiciones de la practica endovascular, un dispositivo de soporte con una inclinación de 45° para posicionar la placenta y un cráneo cadavérico seco fijado a un cabezal de Sugita.
La utilización de la técnica microquirúrgica en neurocirugía ha ido evolucionando de manera sostenida desde sus orígenes en 1961, fecha en que el Prof. Julius Jacobson de la Universidad de Vermont (EE.UU.) realizara la primera microneurocirugía vascular al realizar una endarterectomía de la arteria silviana ayudado por un microscopio quirúrgico.1
Como reportado por el mismo cirujano, esta primera experiencia se caracterizó por un prolongado periodo previo de trabajo en el laboratorio con la finalidad de desarrollar y perfeccionar las habilidades microquirúrgicas necesarias.2,3
Esta correlación directa laboratorio-quirófano ha sido desde un principio la base del desarrollo de nuevas técnicas e indicaciones neuroquirúrgicas aplicadas a las patologías vasculares cerebrales.
La obra de “Maestros de la Neurocirugía” como Yasargil, Spetzler y Evandro de Oliveira entre otros, ha logrado empujar los límites de nuestra especialidad basándose justamente en el concepto que el desarrollo del neurocirujano y la neurocirugía comienzan a partir de un detallado conocimiento de la anatomía y de la adquisición de una rigurosa habilidad microquirúrgica desarrollada y perfeccionada en el laboratorio.4-6
Esta correlación sigue teniendo una increíble vigencia en nuestros días, donde nuevas posibilidades microquirúrgicas ofrecidas por el desarrollo de múltiples y diferentes tipos de by-pass, logran resolver eficazmente aneurismas complejos no solucionables por un clipado clásico o mediante técnicas endovasculares.7-9
Estas nuevas técnicas vuelven a remarcar la importancia preponderante del trabajo en el laboratorio como base del desarrollo del neurocirujano y de la neurocirugía como especialidad y de ahí la importancia de diseñar metodologías de trabajos en el laboratorio que permitan formarse y perfeccionarse en las mismas.
En mi opinión la mejor metodología sigue siendo la del trabajo en arterias “vivas”, con animales de experimentación anestesiados y bajo condiciones quirúrgicas reales. Desde que hice mi formación neuroquirúrgica avanzada con el Prof. Evandro de Oliveira en Sao Paulo, soy un gran apasionado de la técnica microquirúrgica y del laboratorio de microcirugía. En el año 1999 armé un laboratorio y un curso de Técnicas Microquirúrgicas en mi hospital y hasta la fecha realicé 134 cursos de 50 horas de duración cada uno en los que se han formado más de 300 microcirujanos. La técnica adquirida en el animal vivo es directamente transpolable a nuestro quehacer quirúrgico, pero existen otras fortalezas. A lo largo de los años ha sido increíble ver como uno de los factores más importante en el cambio de la aptitud quirúrgica del cirujano ha sido el error. Mi sensación es que la ruptura inesperada de un tejido o un vaso sanguíneo durante la cirugía de un animal vivo cambia la “mano y el cerebro” del cirujano transformándolo en un cirujano inconscientemente más cuidadoso, delicado y detallista, virtudes fundamentales del microcirujano vascular.
Sin embargo, los costos necesarios para realizar microcirugías en animales anestesiados son muy elevados y junto a la estricta reglamentación existente para la habilitación de este tipo de laboratorios, se pueden transformar en un factor limitante para el acceso a estos cursos. De acá la necesidad de encontrar metodologías supletorias y la utilización de placentas humanas se presenta como una opción muy valedera en mi opinión.
Artículos como este permiten interiorizarse con detalle sobre las características de estos ejercicios y la extensa y detallada iconografía presentada por los autores se transforma en un elemento muy valioso para el lector a la hora de llevarlos a la práctica.
Es muy importante remarcar la riqueza de prácticas que el modelo presentado permite realizar con ambas metodologías. Para la parte microquirúrgica, los autores diseñaron ejercicios de disección, sutura de vasos longitudinal, by-pass con anastomosis latero-lateral, latero-terminal y término-terminal con y sin injerto, clipado de aneurismas de bifurcación, trifurcación, terminales, laterales y de aneurismas de transposición, venosa o arterial. Para la práctica endovascular lograron simular embolizaciones aneurismáticas con coils y embolización vascular con partículas de Spongostan ®. Todo esto enriquecido por la utilización de cráneos cadavéricos con un sistema de fijación quirúrgica, bombas de infusión continua y dispositivos de posicionamiento placentarios para incrementar la fidelidad de simulación del modelo.
Estoy seguro de que la lectura de este articulo será de mucha ayuda para todos los neurocirujanos interesados en el desarrollo y perfeccionamiento de habilidades microquirúrgicas, no solo para la patología vascular sino para todo el espectro de acción de nuestra querida especialidad.
Matteo Baccanelli
Hospital Italiano de Buenos Aires. C.A.B.A. Argentina.
BIBLIOGRAFÍA
COMENTARIO
En el campo de la patología vascular cerebral, dada una leve tendencia hacia la resolución de este tipo de patología por vía endovascular, se genera la creciente preocupación en cuanto a la menor exposición de neurocirujanos en formación al tratamiento quirúrgico de aneurismas cerebrales, con la consecuente mayor dificultad para adquirir técnicas microquirúrgicas adecuadas para la resolución de este tipo de enfermedad. Es por eso que nos trazamos como objetivo que en nuestro programa un residente al finalizar su formación participe activamente en un promedio de 30 cirugías de cliapdo de aneurisma cerebrales, pero, la falta de practica por parte de los neurocirujanos en formación en esta compleja patología, es una realidad en muchos de los centros de nuestro país.
Es en busca de una solución a este conflicto que recurrimos a la simulación como herramienta de entrenamiento, la cual a su vez aporta un entorno seguro en el cual el neurocirujano en formación puede adquirir y dominar dichas técnicas sin poner en riesgo la salud de un paciente. La posibilidad de abordar y reducir errores en el entorno de un laboratorio de microcirugía lo convierte en una parte importante en la formación de profesionales neurocirujanos.
A su vez, si bien el mejor modelo experimental sigue siendo el animal vivo, dada la menor posibilidad de trabajo con los mismos en nuestro entorno económico actual, la placenta surge como excelente alternativa para el entrenamiento en patología vascular cerebral.
El presente artículo ilustra la utilización de placentas para el entrenamiento en el tratamiento de patología aneurismática, tanto microquirúrgica como endovascular, de una forma detallada y acompañado de imágenes ilustrativas de los pasos necesarios para la recreación de estas prácticas.
Fomentamos la utilización de modelos experimentales para la adquisición de técnicas quirúrgicas en la formación de todo neurocirujano, siendo la placenta, dentro de los distintos modelos disponibles, un modelo de gran utilidad, no sin antes enfatizar en la importancia de no solo simular sino también conducir al neurocirujano en formación a la práctica real, para que de esta manera se le generen sus propias dudas e inquietudes y busque las respuestas ya que muchas veces esta parte de la información es intransferible.
Pablo Rubino
Hospital de Alta Complejidad El Cruce, Florencio Varela, Prov. Bs. As.