Cirugía de displasia cortical focal en epilepsia farmacorresistente: reporte de casos y revisión de la literatura
Stefania Esther Almagro Allende,1 Matías Berra,1 Flavia Nieto2
1. Servicio de Neurocirugía, Hospital Córdoba de Alta Complejidad, Córdoba, Argentina
2. Servicio de Neurología, Hospital Córdoba de Alta Complejidad, Córdoba, Argentina
Recibido: 13/11/2024. Aceptado: 20/02/2025
Stefania Esther Almagro Allende
almagrostefi@gmail.com
DOI: 10.59156/revista.v39i01.583
ORCID
Stefania Esther Almagro Allende: 0009-0002-0339-8547
Matías Berra: 0009-0005-4995-7270
Flavia Nieto: 0009-0001-5959-8786
EMAILS
Matías Berra: drberra@hotmail.com
Flavia Nieto: nietoflavia2@gmail.com
Los autores no declaran conflicto de interés
Los autores no declaran financiamiento.
RESUMEN
Introducción: los gestos terapéuticos concernientes a la epilepsia farmacorresistente (EFR) brindan un escenario donde el papel de la cirugía ha tenido una gran contribución en las últimas décadas en términos de objetivos a alcanzar. Estos no se limitan al cese completo de las crisis, sino que incluyen el denominado “fin paliativo” (conversión a una epilepsia no refractaria, disminución de fármacos antiepilépticos y número de crisis).
Objetivos: optimizar la difusión de la patología y promover la derivación precoz para mejorar los resultados operatorios.
Descripción de casos: caso 1: paciente de 27 años, 5 crisis convulsivas semanales (10 segundos de duración), RM: lesión frontal derecha hipointensa en T1, hiperintensa en T2 de 3 x 2.25 x 2.84 cm. Caso 2: paciente de 60 años, 2-3 crisis convulsivas diarias cada 5-8 días (10 minutos de duración), RM: lesión hipocampal amigdalina derecha hipointensa en T1, hiperintensa en T2 de 2.7 x 2.5 x 1.3 cm.
Intervención: caso 1: abordaje hemicoronal derecho, con uso de electrocorticografía (EcoG) se realizó la exéresis completa de la lesión sin tejido residual epileptógeno. Caso 2: abordaje frontotemporal derecho con polectomía temporal más amigdalohipocampectomía derecha.
Conclusión: el tratamiento quirúrgico en epilepsia ha tenido una evolución permanente basada en el mayor conocimiento de la patología y al avance de las técnicas por imágenes. El panorama es alentador, pero aún se presentan demoras en la derivación al especialista en cirugía.
Palabras clave: Cirugía de epilepsia. Displasia cortical focal. Epilepsia farmacorresistente. Indicaciones de cirugía en epilepsia.
Surgery for focal cortical dysplasia in drug-resistant epilepsy: case report and literature review
ABSTRACT
Background: therapeutic gestures concerning drug-resistant epilepsy provide a scenario where the role of surgery has had a great contribution in recent decades in terms of objectives to be achieved, which are not limited to the complete cessation of seizures but also include the so-called “palliative goal” (conversion to non-refractory epilepsy, reduction of antiepileptic drugs and number of seizures).
Objectives: to optimize the diffusion of the pathology and promote early referrals to improve surgical results.
Case description: case 1: patient aged 27 years, 5 seizures per week (10 seconds duration), MRI: right frontal lesion hypointense on T1, hyperintense on T2, 3 x 2.25 x 2.84 cm. Case 2: patient aged 60 years, 2-3 seizures per day every 5-8 days (10 minutes duration), MRI: right hippocampal-amygdala lesion hypointense on T1, hyperintense on T2, 2.7 x 2.5 x 1.3 cm.
Surgery: case 1: right hemicoronal approach, using electrocorticography complete excision of the lesion was performed without residual epileptogenic tissue. Case 2: right frontotemporal approach with temporal polectomy plus right amygdalohippocampectomy.
Conclusion: surgical treatment for epilepsy has undergone a permanent evolution based on a greater understanding of the pathology and advances in imaging techniques. The outlook is encouraging, but there are still delays in referral to a surgical specialist.
Keywords: Drug-resistant epilepsy. Epilepsy surgery. Focal cortical dysplasia. Indications for surgery in epilepsy.
INTRODUCCIÓN
A nivel mundial se considera que entre cincuenta a setenta millones de personas tienen diagnóstico de epilepsia, de los cuales el 75% corresponde a países en desarrollo. El tratamiento de la epilepsia ha tomado un papel cada vez más relevante con la evolución constante de las técnicas terapéuticas, tanto a nivel farmacológico como quirúrgico.
Se estima que alrededor de ⅓ de los casos es farmacorresistente y que aproximadamente el 50% de ellos podría tener indicación de intervención quirúrgica. Aquellos pacientes con epilepsia en el ámbito de una alteración parenquimatosa cerebral presentan un potencial 1.5 veces mayor de desarrollar epilepsia farmacorresistente (EFR) en comparación con los casos de epilepsia idiopática.1
La Liga Internacional contra la Epilepsia (ILAE, las siglas por su nombre en inglés) define el concepto de EFR como el fracaso en garantizar la libertad de crisis mantenida con el uso de dos fármacos antiepilépticos (FAE) adecuados, correctamente tolerados y en dosis apropiadas suministrados en monoterapia o en tratamiento combinado.2
Uno de los principales factores pronósticos para el desarrollo de EFR es la respuesta inicial al tratamiento con FAE. La tasa libre de convulsiones en pacientes tratados con su primer FAE fue de 49.5% frente al 13.3% de los pacientes que fueron tratados con su segundo régimen terapéutico y del 3.7% con el tercero.3
La displasia cortical focal (DCF) es una causa frecuente de EFR. Según lo informado por servicios de anatomía patológica de centros especializados en cirugía de epilepsia, constituye la primera causa de EFR en menores de 18 años y la tercera en adultos, seguida de la esclerosis del hipocampo y la patología tumoral.4,5
El término DCF fue descripto por Taylor y cols. en 1971 con el fin de nominar una serie de alteraciones histológicas encontradas en preparados de lobectomías de pacientes sometidos a cirugía.6 Si bien la obtención del diagnóstico, en la mayoría de los casos, es a través del estudio anatomopatológico, este hecho ha ido evolucionando en los últimos años con el avance de los métodos de diagnóstico por imagen que han permitido una mayor aproximación etiológica en la evaluación prequirúrgica.
La DCF es un tipo de malformación del desarrollo cortical que presenta anormalidades en las fases específicas de diferenciación y organización del desarrollo cortical con alteraciones secundarias en la migración neuronal. Existen tanto cambios de las células neuronales como de las células gliales. Tiene una prevalencia del 5 al 25% y el 75% de los casos se relaciona a EFR. Las crisis pueden comenzar en cualquier grupo etario pero son más frecuentes en los primeros 5 años de vida, entre los 20-30 años y hasta los 60 años.
Se sostiene que el tejido displásico presenta alteraciones en la expresión de enzimas que intervienen en la síntesis de neurotransmisores y de sus receptores, comportándose como un foco con capacidad altamente epileptógena.4
Se han reportado diferentes tipos de clasificaciones de DCF. Tomando como base los detalles histológicos que sirven como punto de partida para establecer su relación con patrones como la edad, localización, probabilidad de hallazgos en imágenes y, principalmente, como un factor pronóstico a la respuesta al tratamiento quirúrgico, describiremos la más utilizada.
La clasificación de Palmini y cols. es estrictamente histopatológica (Tabla 1), pero se ha logrado establecer que la DCF I es más frecuente en la población adulta, su localización predominante es en el lóbulo temporal y el 30% de los casos tiene alteración en resonancia magnética (RM).
TABLA 1: CLASIFICACIÓN DE PALMINI Y COLS.
TIPOS DE DCF |
SUBTIPOS |
CARACTERÍSTICAS |
MDC Leve |
I |
Heterotopia/Exceso de neuronas en capa I |
II |
Heterotopia/Exceso de neuronas fuera de la capa I |
|
DCF Tipo I |
Ia |
Solo dislaminación cortical (+MDC) |
Ib |
Dislaminación cortical + Neuronas inmaduras o gigantes |
|
DCF Tipo II (Tipo Taylor) |
IIa |
Dislaminación cortical + Neuronas dismórficas |
IIb |
Dislaminación cortical + Neuronas dismórficas y células en balón |
DCF: displasia cortical focal. MDC: malformación del desarrollo cortical.
La DCF II se da en edades más tempranas, manifiesta mayor número de crisis convulsivas, su localización suele ser extratemporal y alrededor del 90% de los casos presenta alteraciones en RM con un 10% de RM negativas. La principal herramienta diagnóstica la constituye la RM cerebral de alta definición. A través de las técnicas de imagen se han podido distinguir entre el 80-90% de las DCF tipo II y el 30% del tipo I. La localización difiere según de qué tipo de DCF se trate, la más frecuente es la localización temporal seguida de la frontal. El 30% de los casos es multilobar.
Lograr descifrar la clave en la elección del tratamiento correcto representa un reto terapéutico e implica que el paciente permanezca libre de crisis con sus respectivas consecuencias en el ámbito familiar, económico y social.
Si se ha llegado al diagnóstico de EFR con etiología probable correspondiente a DCF el siguiente escalón terapéutico lo constituye el tratamiento quirúrgico en donde el trabajo multidisciplinario cobra mayor relevancia.
En la evaluación prequirúrgica se deben analizar las 5 zonas de importancia en cirugía de epilepsia, estas incluyen la zona generadora del síntoma (área que produce la semiología de la crisis), zona de inicio ictal (donde da inicio la crisis), zona disfuncional (área con déficit funcional interictal), zona irritativa (área que genera picos interictales) y la zona lesional (lesión macroscópica epileptógena). En la actualidad se habla sobre una zona epileptógena dinámica en el tiempo que no permanece detenida en una zona específica del tejido cerebral.7 La correcta correlación entre estas define la zona epileptógena (a resecar quirúrgicamente) que debe ser adecuadamente identificada.
Objetivos
Optimizar la difusión de la patología y promover la derivación precoz para mejorar los resultados operatorios.
DESCRIPCIÓN DE CASOS
Caso 1
Paciente de sexo masculino de 27 años con antecedente de EFR, con inicio de crisis epilépticas a los 5 años en forma de crisis focales tónicas asimétricas, sin pérdida de conciencia, con una frecuencia de 5 crisis semanales y una duración de 6 segundos cada una con mayor incidencia durante el período del sueño. Presenta una progresión en cuanto a la intensidad de las crisis en los últimos 3 años con una extensión en la duración de 10 segundos y con desarrollo de caídas de propia altura asociado a múltiples traumatismos craneoencefálicos leves. Se encontraba bajo tratamiento médico con fenitoína 300 mg/día y ácido valproico 2000 mg/día con mención de período máximo de libertad de crisis de 7 días. Refirió un episodio previo de 12 crisis convulsivas desarrolladas en 24 horas que requirió internación y la imposibilidad de mantener una actividad laboral y académica activa. Al examen físico inicial el paciente está lúcido, orientado en tiempo, espacio y persona, sin anormalidades en lo que refiere a la evaluación del lenguaje, pares craneales, examen motor, sensitivo, marcha y control de esfínteres.
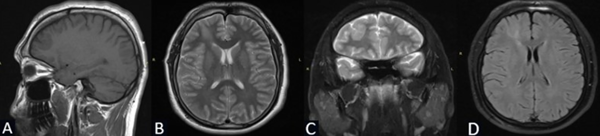
Se solicita RM de cerebro con contraste de cortes de 1 mm donde se objetiva lesión espontáneamente hipointensa en la secuencia T1 localizada en la región frontal derecha entre F1 y F2 de 3 x 2.25 x 2.84 cm. Hiperintensidad de la sustancia blanca subcortical en T2 de forma triangular con base hacia la corteza y vértice hacia la región ventricular (signo del transmanto), engrosamiento cortical focal, pobre delimitación entre la sustancia blanca y gris. Sin efecto de masa y escaso realce tras la administración del contraste (Figura 1).

Figura 1. Caso 1: RM de cerebro. A) Secuencia T1. Corte sagital. B) Secuencia T2. Corte axial. C) Secuencia T2. Corte coronal. D) Secuencia T1 con contraste. Corte axial.
El paciente es conjuntamente evaluado con el servicio de neurología quienes realizan electroencefalograma (EEG) donde se constata el inicio y lateralización de las crisis coincidentes con la zona lesional antes descripta por lo que se indica, de acuerdo a la compatibilidad entre los datos clínicos y de diagnóstico por imágenes, tratamiento quirúrgico de exéresis de la lesión con uso de monitoreo intraoperatorio por electrocorticografía (EcoG). Este fue realizado en el 2020.
Caso 2
Paciente de sexo masculino de 60 años con antecedente de HTA, dislipemia, obesidad y EFR (diagnosticada a los 20 años) bajo tratamiento con carbamazepina 400 mg/día y lamotrigina 150 mg/día. Anteriormente recibió tratamiento con múltiples esquemas de FAE sin lograr un correcto control de las crisis. Presenta crisis tonicoclónicas, con pérdida de conciencia asociada a automatismos bimanuales y orales con recuperación espontánea de la conciencia. Refiere una frecuencia de 2-3 crisis por día cada 5-8 días con desarrollo frecuente de traumatismos de cráneo leves y una duración de 10-15 minutos cada una. Menciona 2 meses como el período máximo de libertad de crisis.
Al examen físico, paciente vigil, bradipsiquia, orientado en tiempo, espacio y persona, lenguaje fluente. Repite, nomina y obedece órdenes. Sin déficit motor ni sensitivo. Esfínteres continentes.
Es valorado por el servicio de neurología quienes realizan videoelectroencefalografía (videoEEG) de 36 canales con electrodos de superficie de una duración de 48 horas. Se utilizó como sistema de facilitación la supresión de FAE. Se registraron 14 crisis tonicoclónicas generalizadas con automatismos y lateralización eléctrica a la derecha. La mayoría se presentaron durante la vigilia. Los hallazgos de videoEEG sugieren la presencia de la zona generadora del síntoma en localización temporal no lateralizada, zona irritativa temporal bilateral con franco predominio derecho y zona de inicio ictal lateralizada a la derecha.
Se solicita RM cerebral con contraste, de cortes finos, donde se evidencia en secuencia T1 imagen de aspecto globuloso en la región hipocampo amigdalina paramediana derecha, ligeramente hipointensa de 2.7 x 2.5 x 1.3 cm. En T2 se comporta como hiperintensa, sin efecto de masa, sin edema perilesional. No presenta cambios posteriores a la inyección del medio de contraste (Figura 2).
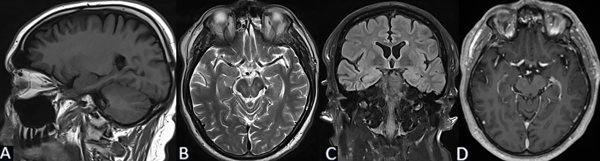
Figura 2. Caso 2: RM de cerebro. A) Secuencia T1. Corte sagital. B) Secuencia T2. Corte axial. C) Secuencia T2 “TIRM Dark Fluid”. Corte coronal. D) Secuencia T1 con contraste. Corte axial.
A partir de los resultados de la evaluación neurocognitiva se concluye que el paciente, de acuerdo a su edad y años de escolaridad (tercer grado), presenta indicadores de deterioro cognitivo leve, tipo multidominio amnésico compatible con trastorno neurocognitivo menor según DSM V (Diagnostic and Statistical Manual of Mental Disorders). Presenta bajo rendimiento en tareas de atención sostenida, alteraciones ejecutivas en control inhibitorio verbal, memoria de trabajo y capacidad de abstracción. Curva de aprendizaje poco productiva. Rendimiento limítrofe en memoria diferida a corto y largo plazo. Dentro de los aspectos comportamentales presenta reserva cognitiva media-baja con registro de sintomatología neuropsiquiátrica significativa: ansiedad, irritabilidad o labilidad e incapacidad para reconocer su condición médica (falta de “insight”).
Conforme con la concordancia entre los métodos suplementarios de diagnóstico (RM de cerebro y videoEEG) en el marco de EFR se determina la conducta quirúrgica como método de tratamiento. Este se realizó en el 2021.
INTERVENCIÓN
Caso 1
En el acto quirúrgico se posicionó al paciente en decúbito dorsal, con disposición cefálica neutra en ligera flexión. Se realizó un abordaje hemicoronal derecho, con disección en dos planos del colgajo musculocutáneo. Craneotomía frontal derecha centrada en el área lesional localizada a 2 cm de la línea media y a 7 cm precoronal.
Mediante la apertura dural en H se identificó la presencia de cambios corticales a nivel frontopolar derecho. Se colocó grilla de 16 contactos en la circunvolución frontal superior y media derecha para control por EcoG con objetivación de descargas a nivel de los contactos 2-3-10 y 11 (Figura 3). Se realizó exéresis de la lesión con confirmación posterior, mediante el uso de EcoG, de la inexistencia de tejido residual epileptógeno (Figura 4).

Figura 3. Caso 1. A) Región dorso lateral frontal derecha precoronal. B) Grilla de 16 contactos. C) EcoG prerresección: patrón de ondas de alto voltaje, continuas, con una frecuencia mayor a 4 Hz sobre los canales que corresponden a los contactos 2-3-10-11.
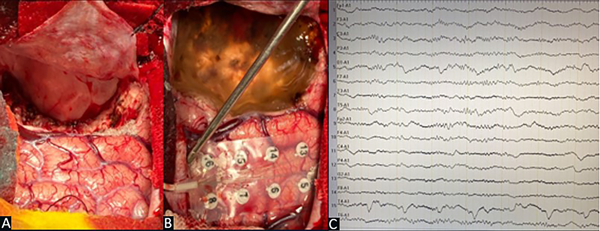
Figura 4. Caso 1. A) Lecho quirúrgico. B) Control postresección de zona perilesional. C) EcoG postresección: resolución completa de la actividad epileptiforme.
El informe anatomopatológico arrojó el resultado de displasia cortical focal tipo IIb de Taylor (Figura 5).
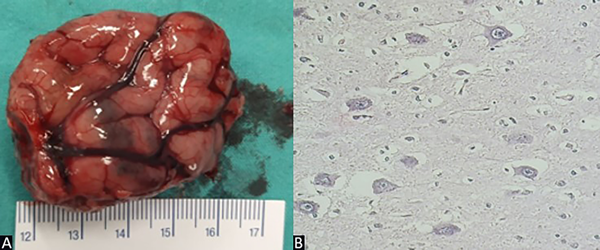
Figura 5. Caso 1. A) Exéresis de lesión de 4.5 cm de largo. B) Preparado de anatomía patológica: alteración de la laminación cortical, neuronas dismórficas y gigantes, células en balón, núcleos grandes y múltiples.
El paciente cursó su postoperatorio inmediato en unidad de terapia intensiva sin cambios al examen físico con respecto a la primera evaluación, con indicación de alta hospitalaria debido a la correcta evolución clínica.
Retomó su actividad académica (secundaria) y laboral. Permaneció durante un año con el mismo esquema de FAE con la consecuente suspensión total de la medicación, hasta la fecha no presentó crisis convulsivas, lo que configura en la escala de Engel la clase tipo I (Tabla 2).
TABLA 2: CLASIFICACIÓN DE ENGEL
CLASIFICACIÓN DE ENGEL |
DESCRIPCIÓN |
Clase I: libre de crisis |
a) Completamente libre de crisis desde la cirugía |
b) Solo crisis parciales simples no discapacitantes desde la cirugía |
|
c) Algunas crisis discapacitantes después de la cirugía, pero libre de crisis en por lo menos los últimos 2 años |
|
d) Crisis generalizadas después del retiro de los anticonvulsivantes |
|
Clase II: crisis infrecuentes |
a) Inicialmente libre de crisis discapacitantes, pero con crisis de manera infrecuente actualmente |
b) Crisis discapacitantes infrecuentes desde la cirugía |
|
c) Crisis ocasionales discapacitantes desde la cirugía, pero infrecuentes en los últimos 2 años |
|
d) Solo crisis nocturnas, que no provocan discapacidad |
|
Clase III: mejoría significativa o útil |
a) Reducción útil de las crisis |
b) Períodos libres de crisis prolongados que acumulan más de la mitad del tiempo de seguimiento, pero no menores a 2 años |
|
Clase IV: sin mejoría significativa |
a) Reducción significativa de las crisis |
b) Sin cambios apreciables (menos del 60% de reducción) |
|
c) Empeoramiento de las crisis |
Se puede observar en la Figura 6 la RM postquirúrgica de cerebro.
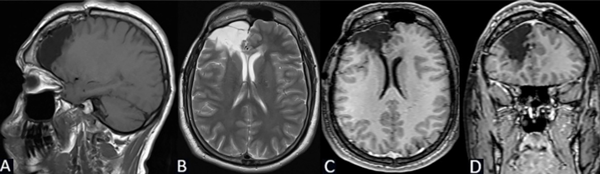
Figura 6. Caso 1: RM de cerebro postquirúrgica. A) Secuencia T1, corte sagital. B) Secuencia T2, corte axial. C) Secuencia T1 con contraste, corte axial. D) Secuencia T1 con contraste, corte coronal.
Caso 2
Se posicionó al paciente en decúbito supino con rotación cefálica hacia la izquierda a 30°, en ligera flexión. Se realizó incisión frontotemporal derecha en signo de interrogación invertido. Craneotomía frontotemporal derecha. Apertura dural en C con pedículo hacia arteria meníngea media. Se reflejó colgajo dural con exposición de cara lateral del lóbulo temporal derecho.
Se efectuó medición desde polo temporal derecho con extensión en sentido anteroposterior hasta los 6 cm, se hizo corticotomía a lo largo de la circunvolución temporal superior –inferior a la cisura de Silvio– con extensión en profundidad hasta el surco circular inferior. La disección se extendió anteriormente hasta la cara anterior de la fosa craneal media. Hacia posterior se realizó disección paralela a la fisura silviana con ampliación retrógrada a lo largo de las circunvoluciones temporales media e inferior. El lóbulo temporal basal se disecó con visualización del borde libre de la tienda y del tercer par craneal. Se objetivó hemorragia arterial de una rama de la arteria cerebral posterior (ACP) con requerimiento de colocación de clip Yasargil® FT740T con correcto control de hemostasia. Se completó maniobra quirúrgica con amigdalohipocampectomía derecha con posterior exéresis final del polo temporal derecho.
La evaluación postoperatoria inmediata permaneció sin particularidades con respecto al examen inicial. Transcurridas las 24 horas se constató depresión del sensorio asociado a hemiparesia braquiocrural izquierda (3/5) por lo que se realizó TAC de cerebro con evidencia de ACV isquémico en territorio de la ACP derecha más hematoma extradural temporal derecho con indicación de evacuación quirúrgica.
El paciente cursó el postoperatorio en la unidad de terapia intensiva, agravando el déficit motor hacia una hemiplejia braquiocrural izquierda asociando afasia de expresión.
En el transcurso de su internación presentó marcada mejoría en el examen neurológico, al momento del alta, se encontraba sin alteración del lenguaje y con una hemiparesia braquiocrural izquierda 4/5.
El servicio de anatomía patológica designó el material emitido como DCF tipo IIa de Taylor.
Actualmente mantiene el mismo esquema de tratamiento antiepiléptico y se encuentra en libertad de crisis (clasificación de Engel tipo I).
Se puede observar en la Figura 7 la RM postquirúrgica de cerebro.
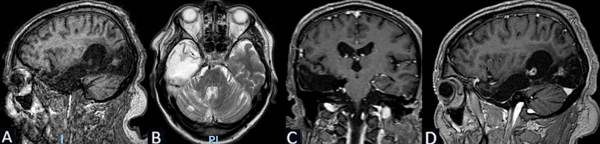
Figura 7. Caso 2. RM de cerebro postquirúrgica: cambios anatómicos del lecho quirúrgico en región temporal derecha con lesión isquémica parenquimatosa secuelar occipitoparietal derecha hipointensa en T1 e hiperintensa en T2. La administración de gadolinio no pone de manifiesto refuerzos patológicos significativos. A) Secuencia T1, corte sagital. B) Secuencia T2, corte axial. C) Secuencia T1 con contraste, corte coronal. D) Secuencia T1 con contraste, corte sagital.
DISCUSIÓN
Los primeros indicios de cirugía de la epilepsia se remontan a épocas tan lejanas como la era hipocrática alrededor del año 357 a. C., pero no fue hasta el 1886, con la contribución de Víctor Horsley, cuando se realiza la primera publicación de este procedimiento: un paciente con epilepsia postraumática secundaria a una fractura con hundimiento frontal.
Posteriormente, con Fedor Krause, se amplió la indicación de conducta quirúrgica, ya no solo para los casos relacionados a trauma craneoencefálico, sino también para casos de epilepsia focal.8
Desde entonces, y hasta la actualidad, se ha producido una firme evolución en lo que respecta a la cirugía de la epilepsia impulsada principalmente por el avance en las técnicas de diagnóstico por imágenes. Esto ha permitido un mayor reconocimiento de las patologías cerebrales relacionadas a EFR, una mayor derivación a centros especializados en cirugía de epilepsia y un superior desarrollo en las técnicas quirúrgicas y de estudios que han mejorado los resultados operatorios, el de mayor relevancia es el uso del monitoreo intraoperatorio (EcoG).
El objetivo de la cirugía en epilepsia abarca no solo la finalización de las crisis, sino otras implicancias en términos de disminución de numero crisis, de dosis de FAE y, por lo tanto, de sus reacciones adversas medicamentosas. Además, se aplica a pacientes que, aun con bajo número de crisis, estas les provocan una gran incapacidad en la vida diaria.
En las últimas décadas se observó una mayor indicación de cirugía en pacientes con epilepsia en los casos llamados “no lesionales”, en quienes se evidencia la zona de inicio ictal en EEG, con posterior confirmación histopatológica, pero sin alteraciones visibles por RM. En los pacientes con RM no lesionales se encuentra que el diagnóstico postoperatorio más frecuente es el de DCF. Se estima que el 60% de estos pacientes tiene RM sin anormalidades en casos estudiados en centros no especializados en cirugía de epilepsia y que ese porcentaje disminuye al 37% en centros especializados. Por lo tanto, también se logra el éxito quirúrgico en casos de DCF sin evidencia de lesiones por RM donde cobra mayor valor la derivación temprana para instaurar el procedimiento quirúrgico apropiado. Este hecho es decisivo, tanto en casos lesionales como no lesionales, para aumentar las probabilidades de libertad de crisis posterior a la cirugía. En casos de EFR del lóbulo frontal en la población pediátrica se demostró que el 66% de los pacientes queda en libertad de crisis si la cirugía tiene lugar antes de que transcurran 5 años desde el diagnóstico de epilepsia, para disminuir al 31% si la cirugía es tardía.
Se describe como factor pronóstico postquirúrgico, además de la realización de la cirugía de forma temprana, el grado de resección completo, la ubicación de la lesión en áreas no elocuentes, la existencia de la zona epileptógena bien definida y el uso de monitoreo intraoperatorio por EcoG que demuestre, posterior a la exéresis, la ausencia de tejido cerebral epileptógeno remanente.
Los elementos que contribuyen de forma deplorable al resultado quirúrgico lo constituyen aquellos en donde la resección es incompleta, la localización es extratemporal, los casos no lesionales por RM y los ubicados en áreas elocuentes cerebrales.
La resección guiada a través del monitoreo intraoperatorio con EcoG con grillas y la adición del uso preoperatorio de RM funcionales en el caso de lesiones ubicadas en áreas elocuentes son medidas que han permitido lograr un mayor grado de resección. Se ha informado que el 80% de los pacientes en donde se realizó una resección completa quedó libre de crisis en el postoperatorio frente al 20% de los casos en donde la resección fue parcial.5
La cirugía de la epilepsia representa una importante opción en el tratamiento de la EFR, no solamente en el contexto del cese de las crisis donde el 60-80% permanece libre de crisis en el seguimiento postoperatorio, sino también en lo que se denomina tratamiento paliativo, pudiendo transformar una EFR a una que sí responda a drogas.
CONCLUSIÓN
Es importante destacar la relevancia que tiene el trabajo interdisciplinario en el diagnóstico de este tipo de patologías y en la identificación de los pacientes que pueden beneficiarse con el tratamiento quirúrgico ya que permite que se acorten los tiempos entre el diagnóstico y la cirugía, lo que configura uno de los principales factores pronósticos en la medida de que estos tiempos sean más estrechos.
Se ha identificado que solamente el 1% de los pacientes con EFR son derivados para la evaluación y por lo general esto ocurre después de que transcurren 20 años desde el inicio de las crisis, esto provoca que la cirugía se produzca en etapas tardías y disminuye así las probabilidades de lograr la libertad de crisis.9
En el contexto de DCF en EFR lograr la libertad de crisis, o el efecto paliativo, que provee la cirugía representa un gran impacto en la calidad de vida de los pacientes y tiene efectos favorables en el ámbito laboral (ya que la mayoría se encuentra laboralmente inactivo), económico y familiar. Además, induce cambios positivos en términos de salud mental dado que es frecuente en estos pacientes el desarrollo de trastornos de ansiedad o depresión.
Un mayor aprovechamiento del avance de las técnicas de imágenes, la realización de programas de difusión en la comunidad médica con el fin de aumentar el reconocimiento de la patología y su derivación temprana con la consecuente conducta quirúrgica precoz reflejaría en el paciente una mejoría sustancial de la calidad de vida en forma global.
Contribuciones de autoría
Conceptualización: Stefania Esther Almagro Allende.
Curación de datos: Flavia Nieto.
Análisis formal: Matías Berra.
Adquisición de fondos: Stefania Esther Almagro Allende.
Investigación: Stefania Esther Almagro Allende.
Metodología: Stefania Esther Almagro Allende.
Administración del proyecto: Matías Berra.
Recursos: Stefania Esther Almagro Allende.
Software: Stefania Esther Almagro Allende.
Supervisión: Matías Berra.
Validación: Matías Berra. Flavia Nieto. Stefania Esther Almagro Allende.
Visualización: Stefania Esther Almagro Allende.
Redacción - borrador original: Stefania Esther Almagro Allende.
Redacción - revisión y edición: Stefania Esther Almagro Allende.
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
BIBLIOGRAFÍA
COMENTARIO
Los autores presentan dos casos de epilepsia farmacorresistente (EFR), los que fueron estudiados e intervenidos quirúrgicamente. En ambos casos, las imágenes de RM preoperatorias sugerían la posibilidad de que la etiología fuera una displasia cortical focal. Considero adecuado el uso de electrocorticografía en los dos casos, ya que existe fuerte evidencia que apoya el uso de esta metodología diagnóstica intraoperatoria cuando nos enfrentamos a esta etiología.1
Como comentario técnico, los neurocirujanos que operamos epilepsia nos enfrentamos a patologías que no alteran de manera significativa la anatomía del paciente, por lo tanto, es indispensable el manejo de la anatomía normal estructural y vascular. La preservación ineludible del plano pial, evita la posible lesión de elementos vasculares y nerviosos, así como en muchos casos provee a la resección los límites sulcales naturales de las displasias corticales.2 El resultado final en control de crisis de los dos pacientes presentados fue óptimo. Agregaría, en la sección de la discusión, que no solo las imágenes funcionales preoperatorias, sino también el mapeo cortical intraoperatorio y el implante de electrodos profundos (estereoelectroencefalografía) permiten la localización de áreas elocuentes y la consecuente elaboración de una estrategia resectiva con respecto al área epileptógena primaria. Por último, concuerdo con los autores en que se necesita aún una derivación más temprana del paciente con EFR a centros especializados, para ingresar a un protocolo diagnóstico y terapéutico adecuado.
Federico Sánchez González
Servicio de Neurocirugía, Clínica de Cuyo, Mendoza, Argentina
BIBLIOGRAFÍA