Resultados de la cirugía endoscópica endonasal y predictores de evolución en la enfermedad de Cushing. Análisis de una serie de 40 casos.
Ana Melgarejo1,2, Mirtha Guitelman3, Gloria Tubert4, Silvina Figurelli5, Sebastian Lescano6, Martín Guevara1,2
1. División Neurocirugía, Hospital Juan A. Fernández.
2. Sección Neurocirugía, Hospital Universitario CEMIC.
3. División Endocrinología, Hospital Carlos Durand.
4. Servicio de Endocrinología, Hospital Juan A. Fernández.
5. División Anatomía Patológica, Hospital Juan A. Fernández.
6. Servicio de Resonancia Magnética Argus, Hospital Juan A. Fernández.
RESUMEN
Objetivo: Evaluar los resultados quirúrgicos y predictores de remisión en una serie de 40 pacientes con enfermedad de Cushing (EC) sometidos a cirugía endoscópica endonasal (CEE) y compararlos con la literatura.
Introducción: La EC esta causada por un adenoma corticotropo y presenta una elevada morbimortalidad. El tratamiento de elección es la resección transeptoesfenoidal, demostrando en los últimos años la CEE ser un alternativa segura y efectiva.
Material y métodos: Se analizó retrospectivamente la base de datos de pacientes con EC operados entre enero de 2010 y diciembre de 2021. Se evaluaron las características clínicas, endocrinológicas, radiológicas, quirúrgicas, histopatológicas y la evolución de los pacientes, y se compararon dos etapas (primeras 20 cirugías vs 20 restantes).
Resultados: Se operaron 32 mujeres y 8 varones, promedio de edad de 38,9 años. Se intervinieron 21 microadenomas y 19 macroadenomas. Se obtuvo remisión postquirúrgica en el 82,5% de los casos encontrándose asociación estadísticamente significativa (p=0,00) con el cortisol postoperatorio ≤ 1,8 µg/dl y con los tumores no invasores de la clasificación de Knosp. En la segunda etapa se obtuvo mayor porcentaje de cortisol postoperatorio ≤ 1,8 µg/dl (73,7% vs 26,3%) y mayor porcentaje de remisión (95% vs 70%). La tasa de complicaciones fue del 20%, sin
mortalidad. Presentaron recurrencia 5 (15%) pacientes. Con tratamiento adyuvante se encuentran en remisión bioquímica 37 (92,5%) pacientes.
Conclusión: La CEE es el tratamiento de elección para la EC ofreciendo altas tasas de remisión con baja morbilidad. Los factores predictores de remisión fueron la hipocortisolemia postoperatoria, los adenomas no invasores y la experiencia del equipo quirúrgico.
Palabras clave: Enfermedad de Cushing. Síndrome de Cushing. Cirugía endoscópica endonasal. Adenoma corticotropo. Hiperplasia corticotropa.
ABSTRACT
Objective: To evaluate the surgical results and predictors of remission in a series of 40 patients with Cushing's disease (CD) undergoing endonasal endoscopic surgery (EEC) and compare them with the literature.
Introduction: CD is caused by a corticotropic adenoma and has a high morbidity and mortality. The treatment of choice is transsphenoidal resection, with CEE proving in recent years to be a safe and effective alternative.
Methods: The database of patients with CD operated on between January 2010 and December 2021 was retrospectively analyzed. The clinical, endocrinological, radiological, surgical, histopathological features and the outcomes of the patients were evaluated on, and two stages were compared. (first 20 surgeries vs last 20).
Results: 32 women and 8 men underwent surgery, mean age 38.9 years. 21 microadenomas and 19 macroadenomas were operated on. Postoperative remission was obtained in 82.5% of the cases, finding a statistically significant association (p=0.00) with postoperative cortisol ≤ 1.8 µg/dl and with non-invasive tumors of the Knosp classification. In the second stage, a higher percentage of postoperative cortisol ≤ 1.8 µg/dl (73.7% vs 26.3%) and a higher percentage of remission (95% vs 70%) were obtained. The complication rate was 20%, with no mortality. 5 (15%) patients presented recurrence. With adjuvant treatment, 37 (92.5%) patients are in biochemical remission.
Conclusion: CEE is the treatment of choice for CD, offering high remission rates with low morbidity. Predictive factors for remission were postoperative hypocortisolemia, noninvasive adenomas, and the experience of the surgical team.
Keywords: Cushing's disease. Cushing's syndrome. endonasal endoscopic surgery. corticotropic adenoma. corticotropic hyperplasia.
MATERIAL Y MÉTODOS
Se analizó de manera retrospectiva una base de datos mantenida en forma prospectiva en la mitad de los casos (20/40). Se evaluaron 40 pacientes intervenidos quirúrgicamente por el mismo equipo neuroquirúrgico en dos hospitales, uno público y uno privado, de la Ciudad de Buenos Aires, en un periodo comprendido entre enero de 2010 a diciembre de 2021. Criterios de inclusión: 1) síndrome de Cushing (SC), 2) RM positiva para tumor hipofisario o cateterismo de senos petrosos inferiores (CSPI) positivo, 3) CEE realizada por el mismo equipo neuroquirúrgico y 4) AP confirmatoria de
adenoma productor de ACTH o hiperplasia corticotropa. Criterios de exclusión: 1) pacientes con antecedentes de cirugía previa, 2) pacientes operados por vía transcraneal o CTSE microscópica, 3) síndrome de Nelson y 4) pacientes con seguimiento menor a 6 meses.
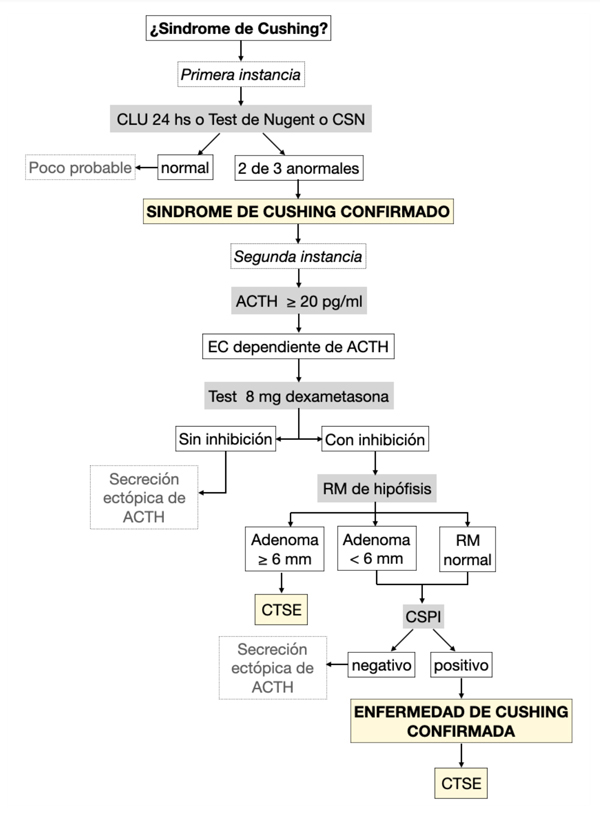
Diagnóstico. (Figura 1)

Figura 1. Algoritmo para el diagnóstico de Enfermedad de Cushing (EC). CLU (cortisol libre urinario). CSN (cortisol salival nocturno). ACTH (adrenocorticotrofina). RM (resonancia magnética). CTSE (cirugía transeptoesfenoidal). CSPI (cateterismo de senos petrosos inferiores).
En primera instancia ante la sospecha clínica de SC se constató el hipercortisolismo endógeno por medio de la demostración de resultados patológicos en por lo menos 2 de los siguientes test:
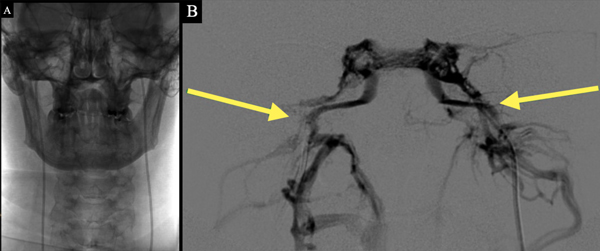
Figura 2. Cateterismo de senos potrosos inferiores. A. Imagen radiológica sin sustracción donde se visualizan ambos catéteres en posición simultáneamente. B. Imagen con sustracción donde se constata correcto posicionamiento de catéteres y tinción de ambos senos petrosos inferiores.
A todos los pacientes se les realizó además de la RM de hipófisis con gadolinio y con secuencia dinámica, tomografía computada (TC) de cerebro y senos paranasales para evaluación y planificación prequirúrgica. Se clasificaron los tumores según el tamaño en microadenoma (<10 mm) y macroadenoma (≥ a 10 mm) y según la escala de Knosp en no invasores (Grados 0, 1 y 2) y en invasores (Grados 3 y 4)26 (Figura 3). Fueron evaluados el resto de los ejes hipofisarios. Se consideraron las complicaciones clínicas más importantes del hipercortisolismo: HTA, DM2, obesidad, osteoporosis , trombosis venosa profunda (TVP) y trastornos psiquiátricos. Se evaluó el tratamiento farmacológico específico previo. Dividimos la serie en dos etapas comparando los primeros 20 pacientes operados con los últimos 20 pacientes (datos prospectivos) para evaluar la curva de aprendizaje.
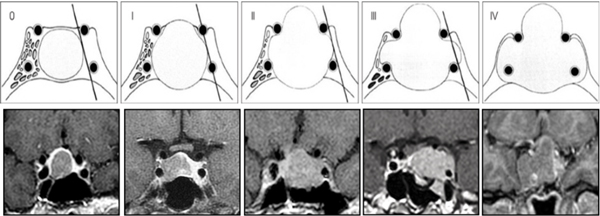
Figura 3. Clasificación de Knosp. Invasión tumoral del seno cavernoso. Grado 0: Sin invasión del seno cavernoso. Grado 1: Sobrepasa la tangente medial (definida como la tangente que une los bordes mediales de la carótida supra e intracavernosa) pero no sobrepasa la línea tangencial que une los dos centros de la de la carótida intra-supracavernosa. Grado 2: Extensión por fuera de la línea intercarotídea, sin sobrepasar la tangente lateral. Grado 3: Extensión lateral a la línea tangencial lateral que une la porción carotídea supracavernosa con la intracavernosa. Grado 4: La carótida intracavernosa está totalmente englobada por el tumor.
Técnica quirúrgica. (Figuras 4 y 5)
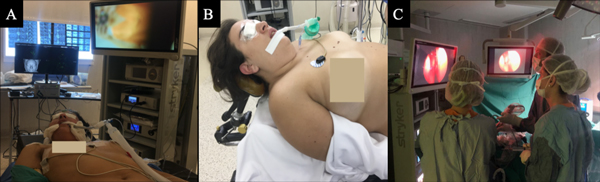
Figura 4. A. Posición quirúrgica, observándose torre de endoscopía y consola de neuronavegación.
B. Vista lateral de la posición quirúrgica de la paciente. C. Posición de los cirujanos.
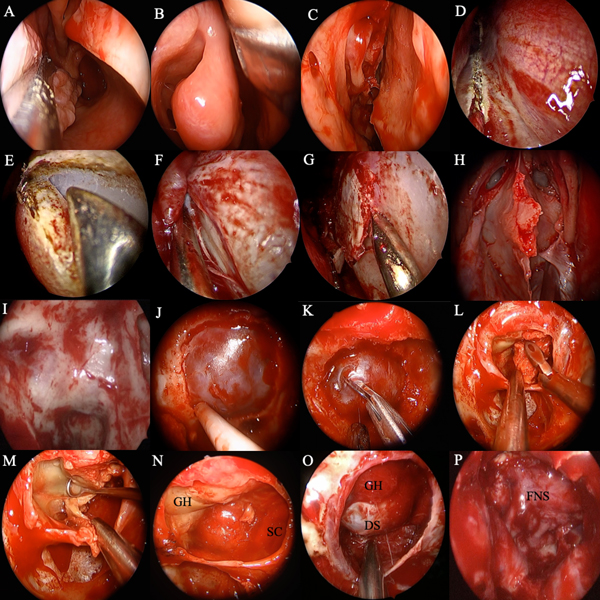
Figura 5. Técnica quirúrgica CEE. A. Lateralización de cornete inferior derecho, visualizando piso de la cavidad nasal y coana. B. Cornete medio derecho. C. Fosa nasal derecha post turbinectomía media. D. Corte inferior de flap nasoseptal. E. Corte superior de flap NS y disección del septum. F. Septum y flap disecados. G. Unión septum cartilaginoso-vómer, septectomía posterior. H. Rostro esfenoidal, ostiums esfenoidales. I. Pared posterior del seno esfenoidal post esfenoidotomía anterior. J. Control de localización carotidea con microdoppler post apertura selar, visualizando duramadre. K. Apertura dural con microtijera. L y M. Resección tumoral con pinza de tumor y cureta. N y O. Cavidad selar post resección tumoral visualizando diafragma selar (DS), seno cavernoso (SC) y glándula hipofisaria (GH). P. Reconstrucción con flap nasoseptal (FNS).
Preparación: bajo anestesia general e intubación orotraqueal se coloca pack orofaríngeo y se efectúa profilaxis antibiótica con clindamicina 600 mg intravenosa. Se introducen algodones embebidos en adrenalina diluída 1:100.000 en solución fisiológica en ambas fosas nasales con el objetivo de lograr vasoconstricción de la mucosa para disminuir el sangrado durante el abordaje. Se posiciona al paciente en decúbito dorsal, con el tórax elevado 20° y la cabeza apoyada sobre un cabezal en herradura, rotada 15° a derecha y ligeramente extendida. Previa protección ocular, se realiza antisepsia con iodopovidona y se colocan campos estériles dejando al descubierto solo la nariz, abdomen y muslo derecho (para eventual obtención de injerto de grasa y/o fascia lata para ulterior reconstrucción). Fase nasal: se realiza una inspección inicial de ambas fosas nasales con óptica de 0°, 4 mm de diámetro y 18 cm de largo. En primer lugar se reclinan lateralmente los cornetes medio e inferior de ambos lados. Por lo general se realiza turbinectomía media derecha, etmoidectomía anterior y posterior derechas, lo cual permite ampliar el corredor nasosinusal derecho. A través del mismo, ingresan la óptica y la cánula de aspiración. Según cada caso, realizamos un flap nasoseptal de rescate (rescue flap)27 o completo (flap nasoseptal de Hadad
-Bassagaisteguy)28. Posteriormente se efectúa la septectomía posterior hasta la esquindelesis esfenovomeriana y el corte de la mucosa septal posterior izquierda para continuar con el abordaje binarinal. Se realiza turbinectomía superior parcial bilateral y se reconoce el ostium esfenoidal izquierdo, completando la exposición completa del rostro esfenoidal. Fase esfenoidal: con técnica bimanual se efectúa esfenoidotomía amplia, se realiza el fresado de los septos esfenoidales y se reseca la mucosa del seno esfenoidal en forma parcial o total de acuerdo al caso. Fase selar: se realiza la apertura amplia de la silla turca entre ambos senos cavernosos y desde el tubérculo selar hasta el piso de la silla. Se constata el posicionamiento y la trayectoria carotídea con Doppler transnasal. Se incide la duramadre con bisturí, inicialmente en el sector inferior con descargas laterales con microtijera, evitando los senos cavernosos e intercavernosos superior e inferior, que particularmente en casos de microadenomas pueden resultar muy prominentes y desarrollados, lo cual puede complicar la apertura dural por el sangrado venoso, profuso y dificultar la visualización de la glándula normal y la resección tumoral. En casos de microadenomas se incide la glándula en forma vertical hasta identificar la pseudocápsula tumoral y se continua la disección en la interfaz entre la glándula y el tumor, una vez aislado se lo extrae con pinza de biopsia (adenomectomía selectiva), preservando la glándula normal (Video 1. Caso 1). En los macroadenomas, dependiendo de la consistencia y tamaño tumoral, se opta por disección extracapsular en aquellos de menor tamaño con consistencia más firme, resección mediante técnica de doble aspiración en los casos de tumores blandos y vaciamiento intratumoral con curetas, disectores y aspiración con posterior resección de la cápsula en casos de tumores de mayor tamaño con consistencia mixta. La resección del adenoma se inicia en el sector inferior para evitar la caída precoz del diafragma selar, continúa por los laterales y finalmente por el sector superior. Idealmente se debe lograr reconocer la duramadre del piso y del dorso selar, la pared medial de ambos senos cavernosos (según el grado de Knosp) y el diafragma selar libres de tumor (Video 2. Caso 2). En casos de RM preoperatoria negativa se realiza la exploración de la glándula inicialmente guiada por el resultado del CSPI (en los casos que hubiera lateralización) realizando incisiones verticales hasta reconocer el tejido tumoral. Se envía una muestra del tumor para anatomía patológica intraoperatoria. Todas las lesiones son remitidas para análisis histopatológico diferido e inmunohistoquímico, PAS y citoqueratina. Con ópticas de 30° y 45° se revisan los recesos intraselares para evitar remanente tumoral en sitios ocultos para la visión central. Se realiza una rigurosa hemostasia con celulosa oxidada regenerada reabsorbible, matriz hemostática con trombina y coagulador bipolar en caso de ser necesario. Cierre: en los casos que no presentan fístula de líquido cefalorraquídeo (LCR) intraoperatoria, se recubre el piso selar con mucosa del cornete medio (injerto libre). En aquellos casos con fístula de LCR, se utiliza sustituto dural (matriz colágena reabsorbible) o injerto de fascia lata intradural y se cubre el defecto selar con el flap nasoseptal, que debe estar en contacto con superficie ósea en todo su perímetro. Se realiza taponaje bilateral con tapones de carboximetilcelulosa con gel hidrocoloide con balón, los cuales se dejan durante 3 días en los casos en los que no hubo fístula de LCR y 5 días en los que sí la hubo. No colocamos drenaje lumbar de rutina. El paciente cursa las primeras 24 horas en UTI (Unidad de Terapia Intensiva) y luego en sala general según evolución.
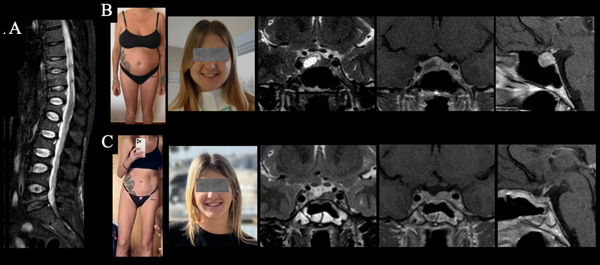
Caso 1. Video 1. Paciente de 30 años que consulta por dolor lumbar invalidante, aumento de peso y debilidad muscular. A. RM de columna dorsolumbar que evidencia múltiples fracturas vertebrales secundarias a osteoporosis severa. B Paciente con estigmas físicos de EC y microadenoma hipofisario centro lateral derecho. C. Postoperatorio: mejoría clínica y RM control sin remanente tumoral.
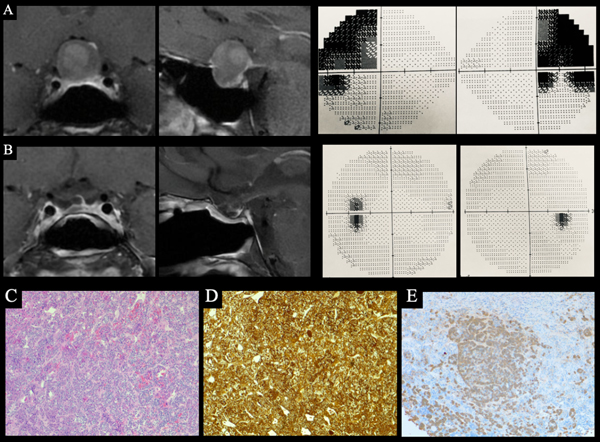
Caso 2. Video 2. Mujer de 54 años, antecedentes de obesidad, HTA, intolerancia a la glucosa y alteraciones visuales. A. Preoperatorio: RM de hipófisis que evidencia macroadenoma selar supraselar con compromiso de la vía óptica. CVC con cuadrantopsia bitemporal superior. B. Postoperatorio: RM sin lesion residual y CVC normal. C, D y E. AP: hematoxilina eosina (x100), técnica de retículo (x100) e inmunomarcación con ACTH (x100) compatibles con hiperplasia corticotropa
Evaluación postoperatoria
Se realizó profilaxis de insuficiencia suprarrenal (ISR) aguda con protocolo de dexametasona 6 dosis de 0,5 mg cada 6 horas iniciando la primera dosis en la inducción anestésica, con el fin de poder valorar la hipercortisolemia en el postoperatorio29. Se midió el cortisol matinal sérico entre el tercer y cuarto día post cirugía. Se clasificaron los pacientes según tuvieron cortisol ≤ 1,8 µg/dl, 1,9 a 5 µg/dl y > 5 µg/dl. Se utilizaron estos puntos de corte debido a que existen estudios que definen la remisión bioquímica postoperatoria con un cortisol matinal sérico < 5 µg/dl dentro de los
7 días postoperatorios17,30, mientras que otros autores utilizan un punto de corte más estricto de 1,8 µg/dl al 2º día postoperatorio31-33. Los pacientes fueron evaluados al 1, 3, 6 y 12 meses postoperatorio y luego anualmente o según necesidad. La remisión fue definida en base a la normalización del CLU, CSN o ISR y consiguiente requerimiento de hidrocortisona como terapia de reemplazo. La persistencia fue definida como la hipercortisolemia sostenida postoperatoria. La recurrencia se definió por la reaparición de síntomas de EC junto con hipercortisolemia luego de un periodo inicial de remisión clínica y bioquímica. Fueron evaluados el resto de los ejes hipofisarios. Se analizaron las complicaciones, la evolución de los pacientes y el tipo de tratamiento adyuvante en aquellos casos en los que hubo persistencia de la enfermedad.
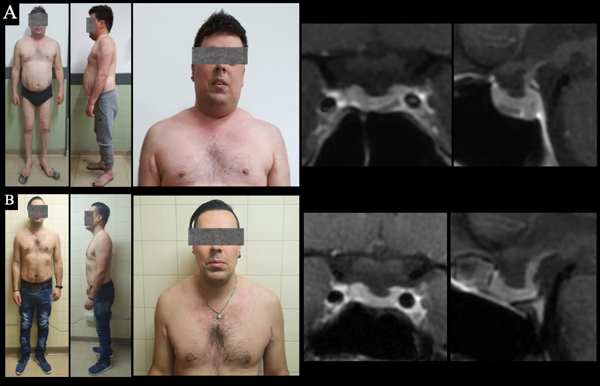
Caso 3. Paciente varón de 31 años que consulta por HTA de difícil manejo y obesidad. A. Preoperatorio: Al examen físico se constata obesidad central, estrías violáceas y cara de luna llena. RM de hipófisis: microadenoma en sector inferior de la hemiglándula izquierda. B. Postoperatorio: mejoría clínica y RM sin lesión.
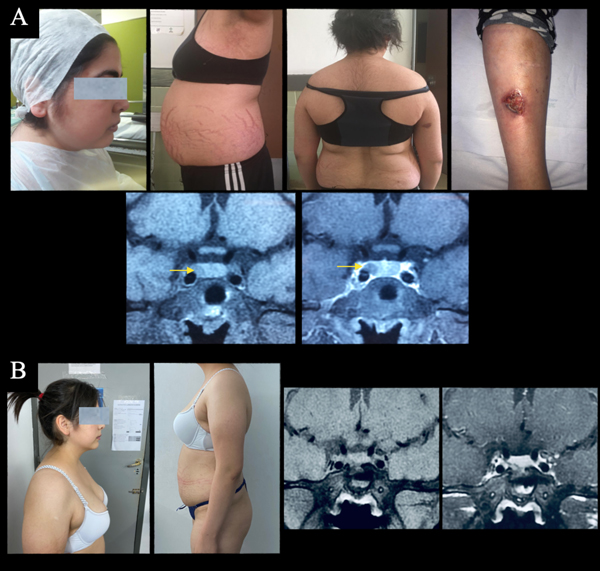
Caso 4. A. Paciente de 18 años con antecedente de HTA, que consultó por amenorrea secundaria, aumento de 15 kg de peso en los últimos 2 años y astenia. Al examen físico presentaba obesidad central, facie de luna llena, piel fina, estrías violáceas abdominales e hirsutismo. Lesión por traumatismo en miembro inferior izquierdo de difícil cicatrización. RM de hipófisis: microadenoma paramediano derecho de 4,6 mm que presenta defecto de tinción post contraste EV. B. Fue intervenida quirúrgicamente lográndose la resección completa del adenoma y la mejoría de todos los síntomas. AP: adenoma corticotropo Ki 67 4%.
Análisis estadístico
Los datos fueron volcados en una base de datos (tipo Excel) y luego analizados con el statistical package for the social science SPSS 26.0. Se realizaron análisis descriptivos, de frecuencia y de tendencia central. Para analizar la asociación entre variables cualitativas se utilizó la prueba del Chi cuadrado. Para analizar las diferencias de medias se utilizó la prueba t de Student para muestras independientes. Un valor de p < 0,05 fue considerado estadísticamente significativo.
RESULTADOS
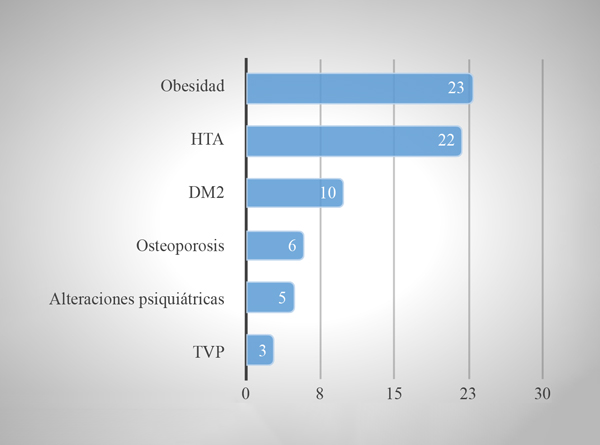
Se incluyeron 40 pacientes que cumplieron con los criterios de inclusión, a los cuales se les realizaron 43 CEE. Representaron el 21% (40/189) de pacientes con adenomas operados mediante CEE en el periodo de estudio. Se intervinieron 32 (80%) mujeres y 8 (20%) varones. La edad promedio fue 38,9±16,9 años (rango 13-77). Poco más de la mitad de los pacientes (57,5% n=23) se atendió en el ámbito privado, mientras que el 42,5% restante (n=17) en el público. La media de evolución de la enfermedad fue de 3,2 (±2,7) años (rango 0,1-10 años). Las comorbilidades de EC más frecuentes fueron: obesidad=23, HTA=22, DBT=10, osteoporosis=6, alteraciones psiquiátricas=5, TVP=3 (Tabla 1). Se presentaron con hipopituitarismo 22 (55%) pacientes, 5 (12,5%) casos con alteración de más de un eje (hipotiroidismo=9, hipertiroidismo=2, hipogonadismo=14, hiperprolactinemia=1). Veintidós (55%) pacientes recibieron tratamiento farmacológico previo con el fin de lograr una estabilización clínica preoperatoria, en 5 casos con dos drogas (ketoconazol=9, cabergolina=8, combinado=5). Seis (15%) pacientes presentaron alteraciones en el CVC, 4 de los cuales tuvieron normalización postoperatoria y 2 mejoría parcial.
Tabla 1.Comorbilidades más frecuentemente presentadas.
Tres (7,5%) presentaron oftalmoparesia del III par, 2 de los cuales tuvieron recuperación completa y 1 parcial.
De los 40 pacientes, en 39 (97,5%) se halló lesión hipofisaria en la RM, 20 (50%) fueron microadenomas, 19 (47,5%) macroadenomas y 1 (2,5%) caso con RM negativa para tumor hipofisario. El tamaño promedio fue de 14,2 mm (rango 2-42 mm). En 7 pacientes con microadenoma < a 6 mm y en el único sin imagen visible en RM se realizó CSPI, obteniéndose gradiente central/periférico positivo en todos los casos, en 6 de ellos con lateralización, la cual fue congruente con la imagen y el hallazgo intraoperatorio. Siete (17,5%) adenomas presentaron invasión del seno cavernoso (Knosp 3 y 4). En el paciente con RM negativa se encontró un microadenoma en la cirugía. (Tabla 2)
Tabla 2. Características demográficas, clínicas y radiológicas prequirúrgicas
| Número de pacientes operados | 40 |
| Número de cirugías | 43 |
| Edad | 38,9 ±16,9 (13-77)
|
| Genero F/M | 32/8 |
| Tiempo de evolución de EC | 3,2 (±2,7) () |
| Tamaño tumoral | |
| Microadenoma | 20 (50%) |
| Macroadenoma | 19 (47,5%) |
| No visible | 1 (2,5%) |
| Knosp | |
| No invasor (0, 1 y 2) | 33 (82,5%) |
| Invasor (3 y 4) | 7 (17,5%) |
| CSPI | 7 (17,5%) |
| Tratamiento médico | |
| Ketoconazol | 9 (22,5%) |
| Cabergolina | 8 (20 %) |
| Combinado | 5 (12,5%) |
| Alteraciones visuales | |
| Hemianopsia | 3 (7,5%) |
| Cuadrantopsia | 3 (7,5%) |
| Oftalmoplejía (III par) | 3 (7,5%) |
Alteraciones endocrinológicas
|
|
| Hipopituitarismo | 22 (55%) |
| Panhipopituitarismo | 1 (2,5%) |
Datos expresados en promedio (rango) y número (porcentaje)
|
La duración de la cirugía fue de 160 (±37,3) minutos promedio (80-240 minutos). La anatomía patológica intraoperatoria fue positiva en todos los pacientes. Se confirmó adenoma corticotropo en la biopsia diferida en 39 casos e hiperplasia corticotropa en 1. El índice de proliferación Ki 67 fue ≤ 3 en 27 (67,5%) casos y > a 3 en 12 (30%) casos. Tuvimos 5 (12,5%) pacientes con adenoma de células de Crooke (ACC).
Se obtuvo cortisol postoperatorio ≤ 1,8µg/dl en 19 (47,5%) casos, de 1,9 a 5µg/dl en 12 (30%) y > 5 µg/dl en 9 (22,5%) (Tabla 3). Una paciente presentó panhipopituitarismo postoperatorio mientras que el resto no agregó un nuevo déficit adenohipofisario.
Tabla 3. Resultados según cortisol postoperatorio
| <1,8 µg/dl | 1,9 a 5 µg/dl | > 5 µg/dl | |
| Total | 19 (47,5%) | 12 (30%) | 9 (22,5%) |
| Etapas | |||
| 1ra etapa (n=20) | 5 (26,3%) | 8 (66,7%) | 7 (77,8%) |
| 2da etapa (n=20) | 14 (73,7%) | 4 (33,3%) | 2 (22,2%) |
| Remisión post primer cirugía | 19 (100%) | 11 (91,7%) | 3 (33,3%) |
| Persistencia | 0 (0,0%) | 1 (8,3%) | 6 (66,7%) |
| Recurrencia | 0 (0,0%) | 3 (25%) | 2 (22,2%) |
Datos expresados número (porcentaje)
|
Datos expresados número (porcentaje)
Las complicaciones relacionadas con la cirugía (20%) fueron: 3 (7,5%) diabetes insípida (DI) transitoria; 2 (5%) epistaxis al octavo y al décimo día postoperatorio, 1 se resolvió con cirugía y coagulación de una rama de la arteria nasal posterior y otro con embolización de la arteria maxilar interna y taponaje; 2 (5%) sinusitis tratadas con cirugía rinosinusal endoscópica; 1 (2,5%) tromboembolismo pulmonar (TEP) al quinto día postoperatorio con requerimiento de anticoagulación con buena evolución. Las complicaciones no mostraron asociación estadísticamente significativa con el tamaño e invasividad tumoral, comorbilidades, institución ni etapa de realización.
El tiempo promedio de internación fue 6,4 días (±5,5). Los días de internación se asociaron al tipo de institución (p 0,00) ya que ésta fue significativamente mayor en hospital público (9,8 días) que en el privado (3,4 días).
Se obtuvo la remisión postquirúrgica en 33 (82,5%) pacientes, encontrándose una asociación estadísticamente significativa (p=0,00) con el cortisol postoperatorio (el 47,5% tuvo ˂1,8µg/dl) y con la clasificación Knosp (el 93,9% de los pacientes con remisión presentó tumores no invasores).
En microadenomas tuvimos una remisión de 95,2% (20/21) y en macroadenomas la fue del 68,4% (13/19) (Tabla 4).
Tabla 4. Resultados post primer CEE de acuerdo a las características radiológicas
| Remisión | Persistencia | |
| Total (n=40) | 33 (82,5%) | 7 (17,5%) |
| Microadenoma (n=20) |
19 (95%) | 1 (5%) |
| Macroadenoma (n=19) |
13 (68,4%) | 6 (31,6%) |
| No visible (n=1) |
1 (100%) | 0 (0,0%) |
| No invasor (Knosp 0,1 y 2) (n=33) |
31 (93,9%) | 2 (6,1%) |
| Invasor (Knosp 3 y 4) (n=7) |
2 (28,6%) | 5 (71,4%) |
Datos expresados número (porcentaje)
Siete (17,5%) pacientes presentaron persistencia de la EC luego de la CEE; 6 de estos fueron sometidos a radiocirugía, 1 además requirió suprarrenalectomía y 1 quimioterapia para lograr la remisión bioquímica. La restante paciente con persistencia corresponde a un adenoma invasor Knosp 4 que se encuentra con enfermedad activa a pesar del tratamiento farmacológico. De los casos con enfermedad persistente 6 (85,7%) tuvieron cortisol postoperatorio > a 5µg/dl y 1 caso entre 1,9 a 5µg/dl. El seguimiento promedio global fue de 76 (±53,4) meses (rango 6-148), en la primera etapa fue de 124 y en la segunda de 27.
Presentaron recurrencia de la EC 5 (15%) de 33 pacientes y se manifestaron a los 10, 8, 4, 3 y 1 año post cirugía (promedio 5,2 años). Al analizar el comportamiento de las variables se encontró que la totalidad de los casos con recurrencia corresponden a la primera etapa, 2 tuvieron cortisol postoperatorio > 5µg/dl, 3 entre 1,9-5µg/dl y ninguno ≤ a 1,8µg/dl. Se reoperaron 3 pacientes, todos con lesión visible en la RM (2 micro y 1 macro). Luego de la segunda CEE se logró la remisión bioquímica en 1 solo caso, las dos pacientes restantes se encuentran con enfermedad activa. En los otros 2 casos de recurrencia (ambos microadenomas) se optó por la radiocirugía por elección de las pacientes.
En cuanto a las etapas estudiadas (primeras 20 vs las últimas 20 cirugías) no se encontraron diferencias con respecto a las comorbilidades, tiempo operatorio, tamaño de la lesión, invasión ni AP. Se encontró asociación estadísticamente significativa entre las etapas y los valores de cortisol postoperatorio (p=0,01), los valores ˂ 1.8µg/dl en su gran mayoría (73,7%) correspondieron a la segunda etapa. (Tabla 5).
Tabla 5. Resultados según etapas (Primeras 20 cirugías vs 20 restantes)
| 1ra etapa (n=20) | 2da etapa (n=20)
|
|
| Cortisol postoperatorio | ||
| <1,8 µg/dl | 5 (25%) | 14 (70%) |
| 1,9 a 5 µg/dl | 8 (40%) | 4 (20%) |
| > 5 µg/dl | 7 (35%) | 2 (10%) |
| Post primer cirugía | ||
| Remisión | 14 (70%) | 19 (95%) |
| Persistencia | 6 (30%) | 1 (5%) |
| Complicaciones | 4 (20%) | 4 (20%) |
| Recurrencia | 3 (15%) | 0 (0,0%) |
| Remisión final con tratamiento adyuvante | 17 (85%) | 20 (100%) |
| Tiempo de seguimiento (meses) | 124 ±25,3 | 27 ±17,2 |
Al final del periodo de estudio, con todas las modalidades terapéuticas empleadas, se encuentran con remisión bioquímica 37 (92,5%) pacientes, de los cuales 26 (70,3%) recuperaron la función del eje adrenal, mientras que 11 (29,7%) requieren hidrocortisona de reemplazo. Tres (7,5%) pacientes se encuentran con enfermedad activa con tratamiento farmacológico y en plan de radiocirugía (Figura 6). La evolución final de los pacientes no se relacionó con el tamaño tumoral, anatomía patológica ni Ki 67. Si se encontró una asociación estadísticamente significativa (p=0,00) con la clasificación de Knosp ya que el 93,3% de los pacientes en remisión presentaron tumores no invasores. También se encontró asociación con los valores de cortisol postoperatorio (p=0,00) dado que el 63,3% de los pacientes en remisión presentó valores ˂1.8 µg/dl.
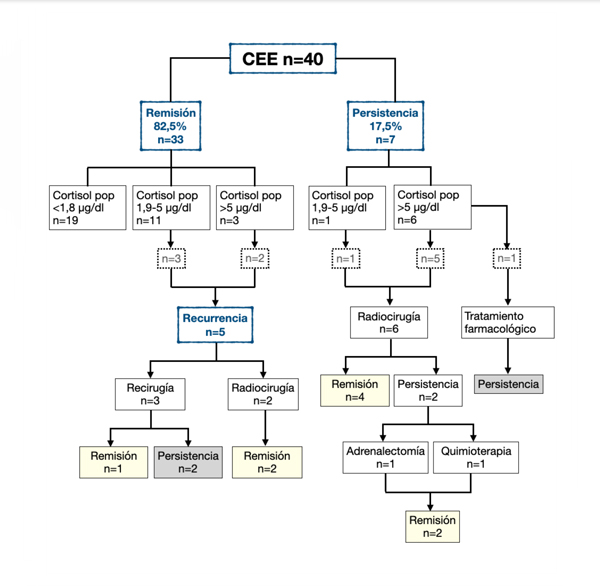
Figura 6. Resultados quirúrgicos y alternativas terapéuticas utilizadas. CEE (Cirugía endoscópica endonasal). Pop (Postoperatorio).
DISCUSIÓN
En este estudio reportamos nuestra experiencia y resultados en 40 pacientes con EC operados mediante CEE. Las características epidemiológicas de la serie fueron similares a las reportadas en otros trabajos: proporción mujer/varón 4:1, edad de diagnóstico promedio de 38,9 años y tiempo promedio de evolución de EC hasta el diagnóstico de 3,2 años2,34,35. La obesidad (57%) fue la comorbilidad más frecuentemente hallada, seguida por HTA (55%) y DM2 (25%), en menor frecuencia encontramos osteoporosis (15%), alteraciones psiquiátricas (12,5%) y TVP (7,5%). La obesidad es el signo más frecuente y la distribución anormal de la grasa se considera el signo más sensible4,35. La evidencia de pérdida de proteínas (osteoporosis, miopatía) es el signo más específico. La conjunción de ambos debe teóricamente permitir distinguir entre hipercortisolismo y obesidad simple1. Una vez hecho el diagnóstico de EC es mandatoria la intervención inmediata. Sin embargo, algunas situaciones pueden requerir el uso de un tratamiento médico primario, como en pacientes con hipercortisolismo grave potencialmente mortal, una situación que puede ser manejada con inhibidores de la esteroidogénesis de acción rápida36. En nuestra serie 22 (55%) pacientes recibieron tratamiento farmacológico previo, de los cuales 13 fueron tratados con ketoconazol. Por otro lado se sabe que los adenomas corticotropos expresan receptores de dopamina, por lo cual los agonistas dopaminérgicos, en particular la cabergolina, se utilizan actualmente como tratamiento off-label (no aprobado) para la EC, obteniéndose mejora del cuadro clínico con buen perfil de seguridad37. Fueron tratados con cabergolina 13 pacientes (sola o en combinación con ketoconazol), la mayoría por un periodo de tiempo corto previo a la cirugía.
La EC se debe con frecuencia a microadenomas monoclonales benignos y de crecimiento lento38. A diferencia de lo reportado39,40 en esta serie tuvimos un número bastante similar de microadenomas 50% y madroadenomas 47,5%, y 1 (2,5%) solo paciente no presentó tumor visible en RM. Valassi y col.reportaron 60% de microadenomas, 21% macroadenomas y 19% sin lesión visible en RM en su serie de 296 casos41.
La resección vía transeptoesfenoidal del adenoma corticotropo es el tratamiento de elección en la EC; estudios previos han reportado un rango de remisión bioquímica postquirúrgica que va desde 59-98%9,10,12,42,43. En los últimos 20 años la CEE ha demostrado desempeñar un rol principal en el tratamiento de esta patología, presentando similar rango de curación con respecto a la CTSE microscópica con la ventaja de permitir una visión más cercana y panorámica del campo quirúrgico, mejor iluminación y mejores ángulos de trabajo dentro de la silla turca gracias a las ópticas de 30° y 45°, lo cual es de vital importancia para detectar tumor remanente44,45. A nivel mundial diversos grupos presentaron tasas de remisión bioquímica post CEE entre el 60 y 87%,46-50. La
tasa de remisión postquirúrgica general de nuestra serie fue del 82,5% (33/40). Si se tienen en cuenta los microadenomas, los mejores índices de remisión van de 88 a 90% [9,51], en nuestro caso tuvimos una remisión de 95,2% (20/21). En los macroadenomas la tasa de remisión es menor y ha sido reportada entre el 17 y 68%9,52; en nuestra serie fue del 68,4% (13/19). La dificultad en la resección quirúrgica completa podría deberse en microadenomas a sangrado de senos intercavernosos, imposibilidad de reconocer la lesión y sus márgenes; y en macroadenomas fundamentalmente al grado de invasividad53,54.
A pesar de la remisión clínica y bioquímica, la recurrencia de la EC han sido reportada en el 2-35% de los pacientes, dependiendo de los criterios de curación y el tiempo de seguimiento31,55. En la presente serie tuvimos una tasa de recurrencia del 15% (5/40), la totalidad fue en la primera etapa, en pacientes que presentaron mayor tiempo de seguimiento (124 vs 27 meses promedio). Se ha visto que la recurrencia generalmente se encuentra en el mismo sitio o adyacente al de origen inicial del adenoma, y en estos casos juega un rol importante un remanente microscópico de la lesión.
Fueron reportados como predictores de remisión: niveles de cortisol postoperatorio, tamaño e invasividad tumoral, RM positiva, confirmación histológica y experiencia de los cirujanos. Algunos estudios sugieren que valores menores a 5 µg/dl dentro de los 7 días postoperatorios son indicativos de remisión17,56. Otros han definido valores más estrictos, <1,8µg/dl al tercer día postoperatorio como indicador precoz de remisión, asociado a una baja tasa de recurrencia (aproximadamente 10% a los 10 años)5,30,57. Ninguno de nuestros pacientes de la primera etapa con cortisol postoperatorio menor a 1,8µg/dl mostró persistencia ni recurrencia, tampoco los de la segunda etapa aunque el seguimiento es menor. De los 13 pacientes con cortisol postoperatorio de entre 1,9-5 µg/ dl 12 presentaron remisión y 1 persistencia; el 23% (3/13) tuvo recurrencia a largo plazo. De los 9 pacientes con cortisol mayor a 5 µg/dl, 6 tuvieron persistencia de EC, 3 remisión y 2 recurrencia luego de remisión inicial. Si bien la mayoría de los estudios describen menor remisión en pacientes con RM negativa56,58,59, algunos reportan similares resultados en pacientes con RM positiva y negativa 49,60. En esta serie no pudimos obtener conclusiones debido a que tuvimos un solo paciente con RM negativa, el cual tuvo CSPI positivo y hallazgo intraoperatorio de microadenoma, con histología confirmatoria y remisión de la enfermedad. Las tasas de remisión en adenomas invasores en EC al igual que en otros subtipos de adenomas son menores61. La confirmación intraoperatoria de invasividad fue reportada como predictor negativo de remisión53,54,56. En nuestra serie tuvimos 7 (17,5%) pacientes con adenomas invasores y solo en 2 se obtuvo la remisión bioquímica.
En todos los casos tuvimos confirmación histopatológica intraoperatoria y diferida (39 adenomas corticotropos y 1 hiperplasia corticotropa). Según la bibliografía, el riesgo de persistencia de EC aumenta cuando no se encuentra el adenoma durante la cirugía y cuando la histología es negativa61,62. El Ki 67 fue > 3 en 12 (30,7%) casos, no evidenciándose diferente evolución en este subgrupo de pacientes. La literatura recomienda un seguimiento más estricto en aquellos pacientes con un índice de proliferación Ki 67 ≥ 363. En cuanto a los ACC, estos tienen una prevalencia del 0-8% y representan un subtipo raro de adenomas corticotropos que tienen como característica que la mayoría de las células (>50 %) exhiben depósito citoplasmático en forma de anillo de citoqueratina, conocido como cambio hialino de Crooke64. Según la clasificación de la Organización Mundial de la Salud (OMS) de los tumores de los órganos endócrinos de 2017, existe un subtipo de adenomas hipofisarios que muestran un comportamiento más agresivo, entre los cuales están incluidos los adenomas de células de Crooke65. En nuestra serie representaron el 12,5% (5/40) de los casos, algo mayor a lo reportado en la literatura, y en su mayoría fueron mujeres (4/5), macroadenomas (4/5), casi todos en la segunda etapa luego de la clasificación de la OMS; no encontramos características especiales diferenciales en cuanto a la evolución final en estos pacientes. Tuvimos un caso en el que la AP diferida informó hiperplasia corticotropa (mujer con macroadenoma con remisión postoperatoria), aun se encuentra en debate si esta entidad es o no un paso inicial previo a la génesis de un adenoma corticotropo o si es consecuencia de secreción de hormona liberadora de corticotrofina (CRH) hipotalámica elevada o receptores de CRH corticotropos hipersensibles66.
De los 6 pacientes con alteraciones en el CVC, todos presentaron mejoría y ninguno empeoró en el postoperatorio. La recuperación fue completa en 4 y parcial en 2. Las gravedad de las alteraciones visuales relacionadas a los macroadenomas en general se asocia al tamaño tumoral, edad del paciente, estado preexistente y tiempo de evolución del déficit. En la literatura se ha publicado normalización de la visión en el 27% a 50% de los casos, mejoría en el 39% a 88,7% y empeoramiento en el 0,86 a 1,9%67-71.
Según estudios, la probabilidad de recuperar la función del eje adrenal es de alrededor del 50-60% de los pacientes con EC, con un tiempo promedio de 13 a 25 meses y se relacionó la demora en la recuperación con menor edad y mayor tiempo de hipercortisolemia72,73. En nuestra experiencia, 73% de los pacientes recuperaron la función adrenal y el 27% continuan con terapia de reemplazo. La tasa de complicaciones de la CTSE en adenomas hipofisarios en general oscilan entre el 3,3% al 9,3%, pero tienden a ser mayores en los pacientes con EC (rango de 9 a 15%)74. La mayoría de los investigadores sugieren que las complicaciones están asociadas con múltiples factores siendo los más importantes el tamaño tumoral, la invasión local, la extensión de la resección quirúrgica, la biología tumoral y la adecuada preservación de las estructuras anatómicas normales75. Smith y col. reportaron una tasa global de complicaciones menores en EC del 35,4% y complicaciones mayores del 8,5%74; en nuestra serie tuvimos un 20% global, en su mayoría menores y todas resueltas sin secuelas. No hubo casos de fístula de LCR, una de las complicaciones mas mencionadas en este tipo de cirugía junto con el riesgo de meningitis que conlleva; las publicaciones reportan incidencia de fístula y meningitis del 0-7,2% y 0-7,9% respectivamente76-78. Tampoco tuvimos casos de lesión carotídea, una de las complicaciones mas temidas y que en algunos estudios esta reportada con mayor incidencia en la CEE que en la técnica microscópica79. La DI ha sido transitoria en los 5 (7,5%) casos de nuestra serie. Según Laws y col. la incidencia de DI luego de la CTSE varía entre 0,4 y 17% [80]; otros trabajos reportan 10-30% de DI transitoria y 2-7% definitiva81,82. La DI permanente representa la injuria del tallo hipofisario durante la cirugía y en nuestra serie no ocurrió en ningún caso. Smith y col. en su reporte de complicaciones en CEE en EC reportaron que toda la morbilidad permanente se asoció con DI (6,1%), en el 23,5% se desarrolló DI transitoria, la cual fue más probable en una segunda operación (37,9 %) que en aquellos que habían sido sometidos a una sola operación (12,8 %)74. El riesgo de DI permanente es mayor en jóvenes, varones, tumores grandes, reoperaciones y con fístula de LCR postoperatoria12,13,81,83,84. Las complicaciones rinosinusales que tuvimos fueron 2 epistaxis y 2 sinusitis con requerimiento de debridamiento y limpieza quirúrgica. La epistaxis, potencialmente grave, puede ser inmediata o tardía (10 días promedio)11,86. Ha sido asociada con lesión de la arteria etmoidal anterior o sangrado de la rama septal posterior de la arteria esfenopalatina y anticoagulación postoperatoria. El tratamiento depende de la gravedad y puede variar desde taponaje nasal hasta embolización endovascular y/o exploración quirúrgica. Smith y col. reportaron una incidencia del 1,3% en 68 pacientes con EC74. La incidencia global reportada en CEE va del 0,6 al 3%78,87,88. Para evitar esta complicación consideramos importante realizar una hemostasia meticulosa en el tiempo nasal y esfenoidal del abordaje y controlar la misma en el momento del cierre elevando las cifras de tensión arterial, como así también la utilización de tapones nasales con balón por 72 horas. El trabajo multidisciplinario con el otorrinolaringólogo es importante para minimizar la morbilidad rinosinusal89. Por último, una paciente desarrolló TEP al quinto día postoperatorio debiendo ser anticoagulada y evolucionó favorablemente. Si bien existe un riesgo bajo de desarrollar trombosis venosa profunda post CEE (2,5%) en general, en pacientes con EC es más alto (rango 5,5 %–5,9 %)86. Se cree que el estado de hipercoagulabilidad en estos pacientes está asociado con una mayor producción de procoagulantes, activación de la cascada de coagulación y deterioro de la capacidad fibrinolítica. La profilaxis tromboembólica precoz juega un rol determinante para evitar este tipo de complicaciones.
Para el fracaso quirúrgico inmediato y para la recurrencia tardía, existen varias modalidades terapéuticas: segunda cirugía hipofisaria, tratamiento médico, radioterapia o suprarrenalectomía bilateral, las cuales han demostrado distintos grados de eficacia y efectos adversos90-92(Figura 7). Una segunda cirugía debe ser considerada en casos de lesión hipofisaria accesible y visible en RM, teniendo en cuenta que la eficacia reportada es menor que en la primer cirugía (22-75%) y frecuentemente se asocia a un aumento del riesgo de hipopituitarismo, DI y fístula de LCR56,93-95. La recirugía representa un desafío mayor debido a la pérdida de reparos anatómicos y a la formación de tejido cicatrizal, de ahí la importancia que estos pacientes sean tratados en centros con especialistas en patología hipofisaria61. En ningún paciente de nuestra serie con persistencia de EC se optó por repetir cirugía en el periodo precoz. Un estudio reciente reportó la posibilidad de remisión tardía luego de la cirugía en alrededor del 5,6% de casos, esto estaría a favor de un retraso en la reoperación inmediata96. De los 3 pacientes reintervenidos quirúrgicamente (todas recurrencias), solo uno mostró remisión postoperatoria. La resección extracapsular se asocia a un descenso rápido del cortisol postoperatorio y mayores índices de remisión97,98. En ningún caso de recurrencia se consideró la hipofisectomía debido a las complicaciones que dicha cirugía conlleva. Algunos autores sugieren realizar adenomectomía + resección del parénquima circundante o incluso hemihipofisectomía85,99. En nuestra cohorte la radiocirugía fue el tratamiento secundario más utilizado 20% (8/40) logrando remisión en el 75% (6/8) de los casos irradiados. Se demostró una eficacia inicial tanto con la radioterapia multifraccionada como con la radiocirugía estereotáctica (SRS) de sesión única para la EC, siendo la más establecida la radiocirugía con Gamma Knife100,101. La radiocirugía es una alternativa efectiva, segura y bien tolerada, que incluso podría ser considerarada en pacientes con contraindicación para la cirugía. Las desventajas de la radioterapia son el lento inicio de la acción terapéutica y el alto riesgo de hipopituitarismo. Dado que las recurrencias pueden ocurrir muchos años después de la normalización de la secreción de cortisol, el seguimiento longitudinal es fundamental para evaluar estas opciones terapéuticas102.
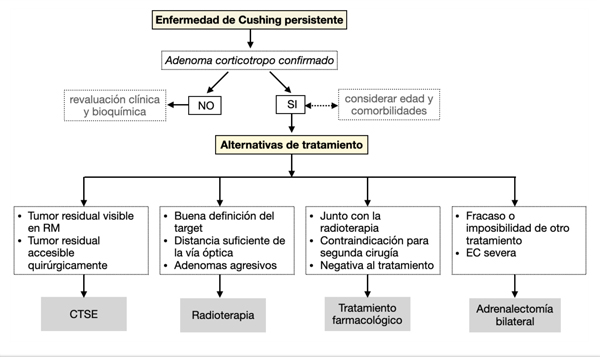
Figura 7. Algoritmo terapéutico para enfermedad de Cushing persistente. CTSE (Cirugía transeptoesfenoidal).
Si comparamos las 2 etapas de nuestro trabajo, teniendo en cuenta la similar composición de ambos grupos en cuanto a tamaño e invasividad tumoral, podemos apreciar el impacto de la curva de aprendizaje evidenciado por el aumento de la tasa de remisión (70% en la primera etapa contra 95% en la segunda etapa). El tiempo quirúrgico, la estadía hospitalaria y las complicaciones fueron similares en ambos grupos. Existen varios estudios que respaldan la importancia de la experiencia quirúrgica en este tipo de patología103-105.
Los pacientes con EC deben ser evaluados por un equipo multidisciplinario compuesto por un endocrinólogo especialista, neurocirujano experimentado, neuropatólogo, neurorradiólogo y radioterapeuta, con el objetivo de maximizar las chances de diagnóstico precoz, tratamiento adecuado y curación.
CONCLUSIONES
La CEE es el tratamiento de elección para la EC ofreciendo excelentes tasas de remisión con baja morbimortalidad. Los factores predictores de evolución favorable fueron la hipocortisolemia postoperatoria, los adenomas no invasores y la experiencia del equipo quirúrgico. Es necesario un seguimiento a largo plazo, teniendo en cuenta que se puede presentar recurrencia incluso varios años después de la remisión, independientemente del tumor y las características del paciente.
Limitaciones
Si bien es un estudio retrospectivo con todas las debilidades y el sesgo que dicha metodología presenta, los últimos 20 pacientes fueron cargados prospectivamente en la base de datos. Todos los pacientes fueron operados con la misma técnica y equipo neuroquirúrgico. La limitación principal radica en el reducido número de casos de nuestra serie y el corto periodo de seguimiento para los pacientes de la segunda etapa teniendo en cuenta la posibilidad de recurrencia alejada que tiene esta patología. Por esto debemos ser cautos y no hablar de curación sino de remisión y control de la enfermedad.
Conflictos de interés
Los autores declaran no tener conflictos de interés que puedan perjudicar la imparcialidad de este trabajo científico. Tampoco existen intereses personales, comerciales ni financieros con drogas, materiales e instrumental que se describen en el presente estudio.
BIBLIOGRAFÍA