
RATAS WISTAR COMO MODELO DE ENTRENAMIENTO MICROQUIRÚRGICO:
Descripción de la anatomía del abordaje cervical y femoral.
Echavarría Demichelis Mickaela1, Sabat Rodrigues Wellerson1, Chuang Joaquín2,3, Baldoncini Matías1,3
1. Servicio de Neurocirugía, Hospital Petrona V. de Cordero, San Fernando, Buenos Aires.
2. Servicio de Neurocirugía, Hospital Alemán, Cuidad de Buenos Aires. 3. Laboratorio de Neuroanatomía Microquirúrgica (LaNeMic) Segunda Cátedra de Anatomía, Universidad de Buenos Aires.
RESUMEN:
Introducción: La utilización de roedores como modelos vivos para el entrenamiento microquirúrgico constituye uno de los métodos prácticos más difundidos. El objetivo del presente trabajo es describir la anatomía quirúrgica de las vías de acceso cervical y femoral en ratas Wistar, como así también los ejercicios básicos de anastomosis vasculares.
Materiales y métodos: Los procedimientos fueron realizados en el Laboratorio del Bioterio Central de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. Se utilizaron 2 ratas de la especie Wistar anestesiadas por vía intraperitoneal. El procedimiento quirúrgico y la descripción anatómica paso a paso se registraron con un dispositivo de cámara y grabación.
Resultados: Se realizó un abordaje cervical con la anastomosis termino-terminal de la arteria carótida común. En el otro espécimen se efectuó un acceso femoral izquierdo y anastomosis termino-lateral entre la vena femoral y la vena epigástrica caudal superficial. Se comprobó la adecuada permeabilidad vascular mediante ecodoppler.
Conclusión: Nuestra experiencia nos permite reafirmar la importancia y la utilidad de adquirir el conocimiento anatómico quirúrgico de las vías de acceso cervical y femoral en las ratas Wistar para el entrenamiento microquirúrgico.
PALABRAS CLAVES: anastomosis vasculares, entrenamiento microquirúrgico, ratas Wistar.
WISTAR RATS AS A MODEL OF MICRO SURGICAL EDUCATION:
ANATOMY AND CLASSICAL EXERCISES
ABSTRACT:
Introduction: The use of rodents as live models for microvascular training constitutes one of the most widespread practical methods. The objective of this work is to describe the surgical anatomy of the cervical and femoral access routes in Wistar rats, as well as the basic vascular anastomosis exercises.
Materials and methods: The procedures were performed in the Laboratory of the Central Animal Facility of the Faculty of Pharmacy and Biochemistry of the University of Buenos Aires. Two rats of the Wistar species anesthetized intraperitoneally were used. The surgical procedure and step-by-step anatomical description were recorded with a camera and recording device.
Results: Anatomy of the cervical and femoral region, made up of muscle groups, fasciae, glands and neurovascular bundles. A cervical approach was made with the end-to-end anastomosis of the common carotid artery. In the other specimen, a left femoral access and end-to-end anastomosis were made between the femoral vein and the superficial caudal epigastric vein. Adequate vascular permeability was verified by Doppler ultrasound.
Conclusion: Our experience allows us to reaffirm the importance and usefulness of acquiring surgical anatomical knowledge of cervical and femoral access routes in Wistar rats for microsurgical training.
KEY WORDS: vascular anastomosis, microsurgical training, Wistar rats
INTRODUCCIÓN
La neurocirugía es una de las especialidades quirúrgicas que requieren del empleo de técnicas microquirúrgicas. Para el desarrollo de las distintas habilidades resulta imprescindible realizar entrenamiento tanto en cirugía como en laboratorio 1-7.
Una de las patologías neuroquirúrgicas que mayor destreza quirúrgica requiere es la patología vascular: dada la baja frecuencia de las mismas, obliga a que los neurocirujanos y residentes en formación opten por diversas técnicas de entrenamiento en laboratorio. La utilización de roedores como modelos vivos para el entrenamiento microquirúrgico constituye uno de los métodos prácticos más difundidos. Para realizarlo de manera correcta es necesario conocer tanto los aspectos éticos, como la anatomía y las distintas vías de accesos a las estructuras vasculo-nerviosos 1-6.
El objetivo del presente trabajo es describir la anatomía quirúrgica de las vías de acceso cervical y femoral en ratas Wistar, como así también los ejercicios básicos de anastomosis vasculares.
MATERIALES Y MÉTODOS
Los procedimientos fueron realizados en el Laboratorio del Bioterio Central de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. El Comité de Ética de la Facultad de Farmacia y Bioquímica del Instituto de Ciencias Médicas aprobó el trabajo experimental (Cudap nro. 35788/19, Resolución Nro 2379). Se cumplieron con los standars de cuidados descriptos por la “International Guiding Principles for Biomedical Research Involving Animals” escrito por el Council for International Organizations of Medical Sciences (CIOMS) y por el International Council for Laboratory Animal Science (ICLAS), Ginebra 2012.
Se utilizaron 2 ratas de la especie Wistar, con un peso de 356 gr y 382 gramos.
El protocolo de trabajo, elaborado por nuestro equipo, consistió en realizar anastomosis microvasculares término-terminal y término-lateral región cervical y femoral respectivamente, comprobando la permeabilidad tanto del vaso dador como del receptor con microdoopler.
El instrumental quirúrgico empleado fue microscopio NEWTON®, modelo MEC XXI serie 2000 con lente de 200 mm, instrumental de macro y microcirugía tales como pinzas de relojero de punta recta y curva, dilatadores vasculares, porta agujas de microcirugía, tijeras de disección, tijeras de adventicia, microclips, clipera, tijera Metzenbaum, mango y hoja de bisturí N 11, plantilla de látex, jeringa de tuberculina con ajuga subcutánea, nylon monofilamento 10-0, retractores dinámicos, etc. El procedimiento quirúgico y la descripción anatómica se registraron con una cámara BlackMagic MicroCinema Camera®.
Anestesia y posicionamiento: los especímenes fueron anestesiadas por vía intraperitoneal con ketamina a dosis de 30mg/kg, y atropina 1 mg/Kg, bajo condiciones estériles.
Se posicionaron las ratas sobre un soporte de madera, en decúbito dorsal, para evitar la compresión torácica y la obstrucción respiratoria (Figura 1 A). Se realizó asepsia y antisepsia de las regiones seleccionadas con clorhexidina .
Una vez finalizado el procedimiento, ambos especímenes fueron sacrificados inyectando aire en el tórax, generando de esta manera un shock por neumotórax hipertensivo.
FIGURA 1. A: Posicionamiento del espécimen utilizando tabla de madera y gomas elásticas. B: Marcación de incisión cervical y femoral.
RESULTADOS
Anatomía de la región cervical:
Fascias:
La región cervical se encuentra cubierta por la fascia subcutánea que se extiende entre la región de las glándulas salivares (submaxilar y sublingual), la región torácica hacia inferior y la región de las venas yugulares externas a los lados.
Inmediatamente profundo a la fascia subcutánea podemos observar las fascias cervicales que se dividen en fascia cervical superficial y la fascia cervical profunda. Esta última se divide en dos capas, una superficial y una profunda. La fascia cervical superficial se encuentra en contacto con la fascia subcutánea.
Glándulas:
Las glándulas sublinguales y submaxilares se encuentran entre la fascia subcutánea y la hoja superficial de la fascia cervical superficial. Estas glándulas mayormente se presentan como una única estructura.
Músculos:
La región cervical contiene diversos músculos de a pares, músculos esternomastoideos (EM), esternohioideos (EH), omohioideos (OH) y digástricos. La importancia en conocer la anatomía de estos músculos radica en que nos permiten ubicar topográficamente el paquete vasculo-nervioso del cuello.
Los músculos esternomastoides y los músculos esternohioideos se originan en el manubrio esternal (Figura 2 A). Los primeros ascienden hacia cefálico y hacia lateral hasta insertarse en la apófisis mastoides. Los segundos ascienden de manera vertical hasta alcanzar el hueso hioides.
Los músculos omohioideos se pueden apreciar entre los dos pares de músculos mencionados anteriormente (Figura 2 B). Se origina en el borde anterior de la escapula y asciende medialmente hasta insertarse en el hioides.
Los músculos digástricos tienen dos vientres, uno anterior que se inserta en la mandíbula y uno posterior que se inserta en la apófisis mastoides. Entre los dos vientres se encuentra un pequeño tendón.
Paquete vásculo-nervioso del cuello:
Está compuesto por la arteria carótida, la vena yugular interna, el nervio vago y la cadena simpática. La vena yugular interna es una vena pequeña que cruza la cara anterior de la arteria carótida. El nervio vago se halla lateral a la arteria carótida mientras que la cadena simpática se encuentra la cara postero-medial de la arteria (Figura 2 C).
FIGURA 2. A: Esquema del primer plano en el abordaje cervical, se observa hacia lateral los músculos esternomastoideos y hacia medial los músculos esternohioideos. B: Esquema del segundo plano de disección, con exposición de músculo omohioideo. En profundidad se ubica la arteria carótida común , X par craneal y la vena yugular interna. C: Esquema del plano profundo donde se visualiza a la arteria carótica interna, junto con el X par craneal. AAC: arteria carótida común. VJI: vena yugular interna. ACI: arteria carótida interna.
Disección cervical:
Se realizó una incisión cutánea lineal tomándose como límite superior la sínfisis mandibular y limite inferior el manubrio esternal (Figura 3 A). Se colocaron retractores para lograr exponer el platisma y las glándulas submaxilares lateralmente (Figura 3 B). Disección del tejido celular subcutáneo hasta identificar el músculo EH. sobre la línea media y el esternomastoideo (ECM) a nivel inferolateral (Figura 3 C,D). Tras retraer hacia lateral el EMC se expuso el triángulo carotideo, un espacio comprendido entre el EMC, EH y el digástrico (Figura 3 E). En profundidad se identificó el músculo OH, el cual se incidió longitudinalmente hasta exponer la vaina carotídea y en su interior a la arteria carótida común (ACC), el X par craneal o nervio vago (NV) y la vena yugular interna (VYI).
Una vez reconocida la ansa cervical, que se extiende a lo largo de la ACC y conduce al nervio hipogloso hacia cefálico, se incidió la misma y se separó la ACC del X par y de la VYI. Se manipuló con delicadeza al NV para evitar el reflejo vagal. Se disecó y reparó la ACC para comenzar con las anastomosis (Figura 3 D).
Anastomosis término-terminal.
Se colocó una almohadilla rectangular de látex debajo de la ACC para facilitar su visualización. Se realizó un clampeo distal y otro proximal con clip de 9 mm. arteriotomía transversal en el espacio comprendido entre ambos clips y lavado de la luz arterial con solución salina heparinizada para liberar los coágulos presentes (Figura 3 E). Con sutura nylon monofilamento 10-0 se realizaron puntos separados entre los extremos distales del vaso hasta lograr su simétrica afrontación. Se completó la anastomosis tanto de la cara anterior como de la posterior de la ACC (Figura 3 F). Se retiraron primero el clip distal y luego el proximal. Finalmente se comprobó la permeabilidad vascular mediante el uso de microdoppler.
FIGURA 3. A: Marcación e incisión para el abordaje cervical desde la sínfisis mandibular hasta el manubrio external. B: Se identifica la fascia cervical superficial y el musculo platisma.
C: Se observa los dos vientres del músculo digástrico, el músculo esternohioideo y la glándula submandibular. D: Se observa la retracción del esternohioideo para acceder al paquete vásculo-nervioso del cuello. E: Se colocan dos clips transitorios en la arteria carótida común. F: Se realiza la anastomosis termino-terminal. Pl: músculo platisma. FCS: fascia cervical superficial. DigA: vientre anterior del musculo digástrico. DigP: vientre posterior del músculo digástrico posterior. EH: musculo esternohioideo. GS: glándula submaxilar. D
Anatomía de la región femoral (Figura 4 A)
Fascias y ligamento inguinal:
Inmediatamente profunda a la piel y el tejido celular subcutáneo podremos encontrar la fascia femoral que cubre al paquete vasculonervioso femoral y forma la fascia vascular que rodea a las estructuras nobles.
El ligamento inguinal se extiende desde la espina superior de la cresta ilíaca hasta el pubis. Dicho ligamento es dependencia del músculo oblicuo externo.
Músculos:
En la región anterior del músculo, se encuentra un grupo muscular denominado cuádriceps femoral compuesto por el músculo recto anterior, vasto intermedio, vasto lateral y vasto medial. Estos músculos se insertan en la superficie anterior, extendiéndose por los bordes lateral y medial del fémur.
Estructuras vasculonerviosas:
Desde lateral a medial se disponen el nodo linfático inguinal, el nervio femoral, la arteria femoral, la vena femoral y el conducto linfático. Están cubiertas por el músculo oblicuo externo y la parte más lateral del músculo recto femoral.

FIGURA 4. A: Esquema del paquete vasculonervioso femoral en donde se evidencia ligamento inguinal, nervio, arteria y vena femoral.
Disección femoral:
Se expuso la región inguinal mediante una incisión en piel de forma oblicua a nivel del punto de transición entre el tronco y el miembro inferior (Figura 5 A). Disección del tejido celular subcutáneo hasta exponer la vaina femoral luego de retraer la piel de la cavidad abdominal con ganchos, sin ejercer demasiada tracción para evitar lesiones del ligamento inguinal (Figura 5 B).
Se identificó el paquete vasculo-nervioso, ordenados de medial hacia lateral: vena, arteria y nervio femoral (Figura 5 C) . Disección del tejido conectivo que rodea a la arteria hasta lograr su separación del nervio y la vena. Se continuó con la disección arterial hacia proximal, separándola del ligamento inguinal y hacia el extremo distal sin sobrepasar el origen de los vasos epigástricos.
Anastomosis termino-lateral
Se anastomosó la vena epigástrica caudal superficial, vaso dador, a la vena femoral, vaso receptor. Se comenzó con la disección prolija de ambos vasos (Figura 5 D). Campleo de los extremos de la vena femoral e incisión longitudinal sobre la cara medial, cuyo tamaño coincidía con el diámetro del vaso dador. Se colocó un clip en el segmento distal de la vena epigástrica superficial y se seccionó su pared de manera transversal. Lavado de la luz de los vasos con solución salina heparinizada a fin de eliminar los coágulos restantes.
Anastomosis con sutura de punto separado entre los extremos de los vasos seleccionados (Figura 5 E). Se retiraron los clips transitorios, respetando el orden ya mencionado, primero el proximal y finalmente el distal (Figura 5 F). Se comprobó la adecuada permeabilidad del flujo sanguíneo mediante microdoppler.
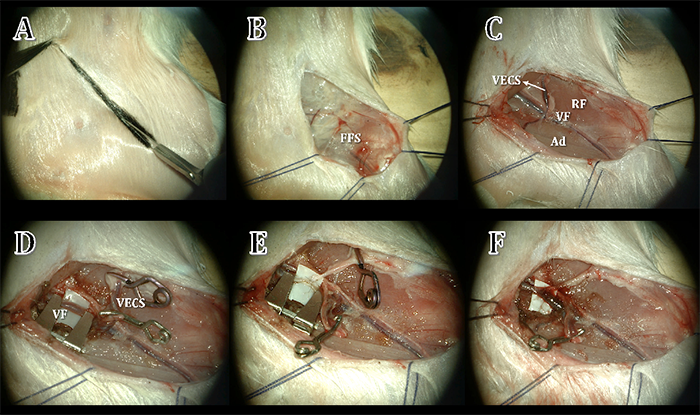
FIGURA 5. A: Marcación e incisión del abordaje femoral. B: Exposición de la fascia femoral superficial. FFS: fascia femoral superficial. C: Identificación del músculo recto femoral, el músculo aductor, los vasos femorales y la vena epigástrica cutánea superficial. D: Se realizan clampeos transitorios. E: Se realiza anastomosis termino-terminal. F: Se comprueba permeabilidad y adecuada anastomisi. RF: recto femoral. VF: vena femoral. Ad: músculo aductor. VECS: vena epigástrica caudal superficial.
Al finalizar los ejercicios microquirúgicos las ratas fueron sacrificadas con sobredosis anestésica, mediante la administración de pentobarbital sódico a dosis de 100-150 mg/kg por vía intraperitoneal.
DISCUSIÓN
Autores como Shurey et al. 5 aseguran que el entrenamiento es indispensable para desarrollar las habilidades para el correcto empleo de las técnicas microquirúrgicas.
Para el entrenamiento microquirúrgico se puede optar por distintos modelos; Higurashi et al. 2 describen cinco categorías de modelos de acuerdo al material utilizado, material sintético, animal vivo, carcaza animal, cadáver humano y modelos inertes. Cobra mayor interés la utilización de modelos vivos para la ejercitación de las técnicas vasculares no solo de anastomosis sino también de disección microquirúrgica de estructuras nobles. Sin embargo, estos modelos presentan problemas éticos y también de disponibilidad material.
Autores como Higurashi et al, Iahiri et al.2,3 postulan que si bien el modelo más fidedigno para reproducir el escenario quirúrgico es el animal vivo, resulta importante desarrollar primero la habilidad manual con modelos inanimados. Iahiri et al. 3 en su trabajo describe la realización de un curso de cinco días, dividiendo a los estudiantes del curso en dos grupos. El primer grupo realizó las prácticas en ratas los cinco días del curso mientras que el segundo grupo utilizó el modelo vivo tres días del curso, y el resto fue reemplazado por modelos sintéticos. Los autores lograron demostrar que se puede utilizar menor cantidad de animales vivos sin afectar la calidad del entrenamiento microquirúrgico. Por su parte, Trignano et al.7 propone una metodología de entrenamiento basado en tres pasos. El primer paso consta en desarrollar las habilidades fundamentales para la correcta utilización del microscopio quirúrgico. El segundo consiste en la realización de suturas en modelos sintéticos como prótesis endovasculares. En el último paso, se realiza anastomosis vasculares utilizando placentas humanas. Este autor concluye que la utilización de esta metodología basada en tres pasos evita la utilización de animales vivos conservando buena calidad de entrenamiento.
El entrenamiento en microcirugía vascular utilizando un modelo vivo no solo consiste en realizar una correcta anastomosis, sino también en abordar y disecar correctamente la estructura vascular o nerviosa y los elementos aledaños. Para ello, es necesario conocer la anatomía microquirúrgica del abordaje.
Autores como Mikami et al. 1 y Tayebi et al 4 describen en sus trabajos la anatomía microquirúrgica para la realización de las anastomosis en roedores. Los dos abordajes más utilizados son a nivel cervical y a nivel femoral. Tayebi et al.6 compara entre los dos modelos de anastomosis y concluye que no hay diferencias significativas entre ambos. En nuestro trabajo, realizamos una pormenorizada descripción anatómica de la región cervical y de la región femoral de la rata Wistar.
El conocimiento de la anatomía microquirúrgica de las regiones en la rata Wistar resulta de crucial importancia para realizar un entrenamiento correcto aprovechando totalmente el recurso. Sería interesante estudiar el impacto que tiene la utilización de los modelos biológicos para el entrenamiento microquirúrgico en los resultados quirúrgicos obtenidos en los pacientes.
CONCLUSIÓN
El conocimiento anatómico quirúrgico de las vías de acceso cervical y femoral en las ratas Winstar resulta importante para la utilización de modelos vivos en el entrenamiento microquirúrgico.
El uso de especímenes constituye un modelo vivo clásico de simulación y entrenamiento sumamente necesario y efectivo para desarrollar destrezas microquirúrgicas en las técnicas de anastomosis vasculares y contribuir así a nuestra formación como neurocirujanos.
BIBLIOGRAFÍA:
1. Mikami T, Suzuki H, Ukai R, Komatsu K, Kimura Y, Akiyama Y, et al. Surgical anatomy of rats for the training of microvascular anastomosis. World Neurosurg. 2018;120:e1310–8.
2. Higurashi M, Qian Y, Zecca M, Park Y-K, Umezu M, Morgan MK. Surgical training technology for cerebrovascular anastomosis. J Clin Neurosci. 2014;21(4):554–8.
3. Lahiri A, Muttath SS, Yusoff SK, Chong AK. Maintaining effective microsurgery training with reduced utilisation of live rats. J Hand Surg Asian Pac Vol. 2020;25(2):206–13.
4. Tayebi Meybodi A, Belykh EG, Aklinski J, Kaur P, Preul MC, Lawton MT. The end-to-side anastomosis: A comparative analysis of arterial models in the rat. World Neurosurg. 2018;119:e809–17.
5. Shurey S, Akelina Y, Legagneux J, Malzone G, Jiga L, Ghanem AM. The rat model in microsurgery education: classical exercises and new horizons. Arch Plast Surg. 2014;41(3):201–8
6. Tayebi Meybodi A, Aklinski J, Gandhi S, Lawton MT, Preul MC. Technical nuances of exposing rat common carotid arteries for practicing microsurgical anastomosis. World Neurosurg. 2018;115:e305–11.
7. Trignano E, Zingone G, Dessy L, Campus G, Fallico N. Microsurgical training with the three-step approach. J reconstr Microsurg. 2016;33(02):087–91.
COMENTARIO
Artículo sobre el entrenamiento vascular microquirúrgico en roedores de laboratorio. Resalto la utilidad del conocimiento anatómico en los abordajes vasculares. Es conocido que un abordaje de mala técnica repercutirá directamente en el tiempo vascular, con posibilidad de trabajo en profundidad, sangrados innecesarios, lesión a tejidos, etc. Asimismo, si se tratase de un modelo con fines de investigación, influiría sobre los resultados de las determinaciones experimentales. El presente artículo realizó la descripción anatómica de 2 abordajes vasculares en 2 animales, lo que disminuye la posibilidad de encontrar variaciones anatómicas y realizar conclusiones con estadísticas significativas.
La rata es el modelo vivo más utilizado. Tiene a favor como principales cualidades la presencia de circulación y pulso arterial, la presencia de coagulación, así como la posibilidad de evaluar el estado clínico del animal luego de la anastomosis (si tolera el procedimiento u observando si el órgano permanece irrigado). No obstante, el uso de animales en el laboratorio es costoso y está sujeto a un marco ético-legal que los torna de difícil acceso. Los animales deben siempre ser tratados mediante normas nacionales e internacionales de ética y bienestar animal, supervisados y evaluados estrechamente por profesionales veterinarios y encontrarse bajo anestesia general antes de realizar cualquier procedimiento invasivo.1
En la actualidad, la tendencia de la experimentación animal sigue la regla de las tres “R” de Russell y Burch: Refinar, Reducir y Reemplazar. “Refinamiento” hace referencia al manejo y las condiciones en la que se desarrolla la vida del animal, el concepto de “Reducción” nos exhorta a disminuir al máximo posible el número de seres vivos que se utilizan en un determinado experimento, y la tercera R refiere al término “Reemplazo”, cuyo significado se traduce en la sustitución del animal por modelos inanimados, que suplan las prácticas en modelos vivos.2
Concuerdo con la expuesto en la discusión, y es valorado en demasía por la literatura internacional, que el entrenamiento en modelos vivos debe excluirse de las prácticas iniciales de entrenamiento quirúrgico, y solo debe abordarse cuando la curva de aprendizaje se encuentra muy avanzada.2,3 Es de gran reelevancia tratar de reemplazar al animal por modelos de simulación de alta complejidad de entrenamiento en microcirugía, como los descriptos recientemente con microflujo y pulso vascular. 4
Si bien la anatomía de la rata Wistar se encuentra descripta en textos con anterioridad, son escasos los que lo hacen aplicado al entrenamiento microvascular de los neurocirujanos.1
Citas Bibliográficas
Jorge Bustamante
Laboratorio de Microcirugía Experimental. Facultad de Ciencias Médicas. UNLP
Hospital de Niños SM Ludovica
Hospital de Alta Complejidad El Cruce
COMENTARIO
En el presente trabajo los autores describen de forma detallada la anatomía quirúrgica de las vías de acceso cervical y femoral en ratas Wistar, como así también los ejercicios básicos de anastomosis vasculares.
La técnica microquirúrgica es una herramienta indispensable para todo neurocirujano1. Para ello, es importante el entrenamiento en el laboratorio que asegura un ambiente seguro y controlado para el aprendizaje de dicha técnica2-4.
Los autores utilizaron modelos vivos para anastomosis vasculares los cuales reproducen con mucha realidad el escenario quirúrgico5. Por ejemplo, en estos modelos se puede presentar la posibilidad de hemorragias con la necesidad de maniobras de hemostasia para su control, sumado a las características y la pulsatilidad de las paredes de los vasos que simula de forma realista las características de los vasos cerebrales humanos.
Además, el presente trabajo presenta numerosas ilustraciones con extremo detalle donde se logra apreciar y entender la intrincada anatomía en estos animales, un paso indispensable para el entrenamiento propuesto.
Finalmente, incluyeron numerosas fotografías donde muestran los diferentes ejercicios microquirúrgicos realizados con su ejecución paso a paso, que permite reproducirlos en cualquier laboratorio de microcirugía.
Felicitaciones a los autores.