Factores que influyen en el grado de resección y propuesta de escala preoperatoria para el manejo de meningiomas de base de cráneo
Trabajo a premio junior Neuromar 2022
Torres, Pilar; Bennum, Guido; Alonso Martina; Matassa Jeronimo; Sanfilippo Fedra; Bevilacqua, Sebastian
Servicio de Neurocirugía, Sanatorio Güemes, CABA, Argentina
Pilar Torres
pilyr4@gmail.com
Recibido: marzo de 2023. Aceptado: marzo de 2023.
DOI del artículo: 10.59156/revista.v37i01.502
ORCID:
Torres Pilar: 0009-0003-2668-7592
Alonso Martina 0009-0007-1848-261
Matassa Jeronimo: 0009-0000-7709-8112
Benum Guido: 0000-0001-7847-0545
Sanfilippo Fedra: 0009-0008-3355-5228
Bevilaqcua Sebastian: 0000-0002-7788-3206
RESUMEN
Objetivos: identificar factores que intervienen en el grado de resección de los meningiomas de base de cráneo y proponer una escala para calcular la probabilidad de resección total.
Materiales y métodos: estudio unicéntrico, observacional, retrospectivo, de pacientes operados en el período 06/2018 – 06/2022. Se utilizaron como variables: edad, clínica, localización, tamaño, embolización previa, edema perilesional, calcio intratumoral, características en T2 y T1 e invasión ósea. El grado de resección se midió con la clasificación de Simpson tradicional y también se dividió en resección total (Simpson I, II y III) y subtotal (Simpson IV y V). Con los resultados se propuso una escala teniendo en cuenta las variables con significación estadística (p < 0.05). Se realizó una revisión bibliográfica del tema.
Resultados: Se operaron un total de 23 pacientes. Fueron estadísticamente significativas asociadas con el grado de Simpson, la localización (p 0,002) y el tamaño (p 0,001). Asociada con resección total y subtotal, la invasión ósea (p 0,013). Para la escala utilizamos: localización (anterior 1 punto, posterior 2 puntos, medial 2 puntos y medial que involucra seno cavernoso 3 puntos), tamaño (<5 cm 1 punto, >5 cm 2 puntos) e invasión ósea (no 1 punto y si 2 puntos). Realizamos un análisis inferencial y se observó asociación entre la escala realizada y el grado de resección (p 0,005).
Conclusión: En nuestro estudio se observó una asociación entre el tamaño, la localización y la invasión ósea con el grado de resección conseguido. Propusimos una escala para medir la probabilidad de resección total.
Palabras claves: análisis estadístico; base de cráneo; escala; estudio unicéntrico; meningioma; Simpson.
Predictive factors in the extent of resection and proposal of a preoperative scale for the management of skull base meningiomas
ABSTRACT
Objectives: identify factors that intervene in the degree of resection of skull base meningiomas and propose a scale to calculate the probability of total resection.
Materials and methods: single-center, observational, retrospective study of patients operated in the period 06/2018 - 06/2022. The following variables were used: age, symptoms, location, size, previous embolization, perilesional edema, intratumoral calcium, characteristics in T2 and T1 and bone invasion. The degree of resection was measured using the traditional Simpson scale and was also divided into total (Simpson I, II, and III) and subtotal (Simpson IV and V) resection. With the results, a scale was proposed taking into account the variables with statistical significance (p < 0.05). A bibliographic review of the subject was carried out.
Results: A total of 23 patients were operated. They were statistically significant associated with Simpson's grade the location (p 0.002) and size (p 0.001). Associated with total and subtotal resection, the bone invasion (p 0.013). For the scale we use: location (anterior 1 point, posterior 2 points, medial 2 points and medial involving the cavernous sinus 3 points), size (<5 cm 1 point, >5 cm 2 points) and bone invasion (no 1 point and yes 2 points). We performed an inferential analysis and an association was observed between the scale used and the degree of resection (p 0.005).
Conclusion: In our study, an association was observed between the size, location and bone invasion with the degree of resection achieved. We proposed a scale to measure the probability of total resection.
Keywords: meningioma; scale; Simpson; single-center study; skull base; statistic análisis.
INTRODUCCIÓN
Los meningiomas constituyen el tumor primario más frecuente del SNC. Se originan a partir de células meningoteliales que se encuentran en la capa aracnoidea de las meninges, pueden estar asociadas con la duramadre o el plexo coroideo, y representan el 36 % de todos los tumores del SNC.1 Crecen a lo largo de la superficie externa del cerebro, la médula espinal o, con menos frecuencia, dentro del sistema ventricular.
Existen 3 grados basados en los criterios de la OMS. Un 80% son grado 1, benignos y de crecimiento lento; 20 - 25% son grado 2 con mayor probabilidad de recurrencia; y un 1- 6% son de grado 3, malignos con potencial metastásico.2
Se presentan a una edad promedio de 65 años. El 66% de los meningiomas cerebrales se dan en mujeres, ascendiendo a 90% cuando se localizan en médula espinal.3
Pueden ocurrir ocasionalmente casos en la población pediátrica, y en general están asociados con síndromes genéticos o radiación infantil.4
La base del cráneo es una región anatómica compleja que forma el piso de la cavidad craneal. Hay diversos procesos neoplásicos que pueden manifestarse en la base de cráneo, con diferente distribución según su localización sea anterior, media o posterior. Los meningiomas pueden desarrollarse en cualquiera de sus localizaciones.
La cirugía es el tratamiento de primera línea para la mayoría de los tumores benignos y malignos de la base de cráneo.5
La resección total macroscópica es el paradigma terapéutico al que se pretende llegar cuando diagnosticamos un meningioma. Basado en la resección tumoral, su remante residual y de la duramadre infiltrada, Simpson introdujo en 1957 una clasificación pronóstica para la extensión de la resección, que se ha aplicado ampliamente en la práctica neuroquirúrgica6. Los Grados I, II y III de Simpson se pueden definir como resección total macroscópica y se asociaron con una menor recurrencia en comparación con el Grado IV y V, definidos como resección subtotal.7,8
El desafío quirúrgico de este tipo de tumor, que como hemos mencionado suelen ser lesiones benignas en su gran mayoría, se debe a la dificultosa accesibilidad dada la anatomía y su proximidad a estructuras neurovasculares críticas. Para evitar complicaciones muchas veces es necesario realizar una resección subtotal y preservar el estado funcional del paciente.9
Por lo cual la planificación prequirúrgica y el establecimiento de los objetivos de la resección tumoral son partes esenciales, y que deben ser individualizadas, para brindar un resultado quirúrgico adecuado.
Es de gran utilidad identificar factores predictivos obtenidos en la valoración preoperatoria que influyan en el grado de resección quirúrgica.El objetivo de este estudio es identificar estos factores tomando en cuenta características, ya sea del paciente o tumorales, que intervienen en el grado de resección de los meningiomas de base de cráneo, y proponer una escala para valorar la probabilidad de resección total.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional, retrospectivo, recopilando datos de historias clínicas de pacientes operados con abordaje transcraneal de meningiomas de base de cráneo durante el período 6/2018 hasta 6/2022 por nuestro equipo neuroquirúrgico del Sanatorio Güemes, CABA, Argentina.
Se incluyeron pacientes mayores de 18 años, sin operaciones previas y con resonancia magnética con contraste y tomografía de cerebro prequirúrgicas.
Se excluyeron pacientes menores de 18 años, con intervenciones quirúrgicas previas y con estudios prequirúrgicos incompletos.
Se analizaron características epidemiológicas y clínicas del paciente, y características del tumor ya sea localización, tamaño, imagenológicas y si tiene embolización previa o no. El grado de resección se midió con la clasificación de Simpson tradicional y también se dividió en resección total (Simpson I, II y III) y subtotal (Simpson IV y V) (Figura 1).

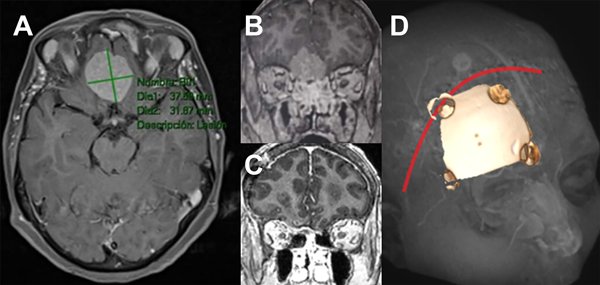
Figura 1: Imágenes representativas de paciente operado de meningioma de base de cráneo anterior de surco olfatorio. A: secuencia T1 con contraste de resonancia magnética, corte axial. B: Misma lesión corte coronal C: corte coronal de imagen posoperatoria. D: abordaje y craneotomía realizada.
Luego, con los resultados obtenidos se propuso una escala para graduar la probabilidad de resecabilidad total o subtotal del meningioma, teniendo en cuenta las variables que hayan tenido significación estadística (p < 0.05).
Finalmente, se realizó una revisión bibliográfica a fin de comparar resultados con otras series.
Protocolos y definiciones de las variables estudiadas
Los pacientes fueron analizados según la edad en tres cohortes: <40 años, entre 40 y 60 años y > de 60 años. Para la clínica los pacientes se dividieron en aquellos asintomáticos en el momento del diagnóstico y en sintomáticos. Los meningiomas de localización anteromedial se definieron como aquellos del surco olfatorio, planum esfenoidal y tuberculum sellae. Los anterolaterales son aquellos que nacen del ala esfenoidal, incluyendo a los del segmento interno o clinoidales, los del segmento medial o alares y los del segmento lateral o pterionales.10 Los de localización medial fueron los del seno cavernoso. Y los de localización posterior los meningiomas petroclivales y del ángulo ponto cerebeloso. Para el tamaño se tomó en cuenta el mayor valor obtenido en cualquiera de sus diámetros y se dividieron en <3 cm, entre 3 y 5 cm y > 5 cm. Dentro de las características que obtuvimos de los estudios por imágenes recopilamos si se observaba calcio o no intratumoral, si tenían edema perilesional, si tenían invasión ósea, y sus características en secuencia T1 y T2. También se obtuvo información sobre si se realizó o no embolización prequirúrgica. El grado de resección se categorizó según la escala de Simpson basada en la observación intraoperatoria del cirujano y su descripción en el parte quirúrgico; también comparando los resultados con la resonancia con gadolinio control posoperatoria. Siendo Simpson grado I extirpación total del meningioma y duramadre, grado II extirpación total de tumor y coagulación de duramadre, grado III extirpación total de tumor sin coagulación de duramadre, grado IV resección parcial y grado V descompresión o biopsia. Hablamos de resección total cuando se logró un Simpson I, II y III, y resección subtotal con Simpson IV y V.
Análisis estadístico
Tomando los resultados de las variables estudiadas de tipo categoriales y con la base de datos obtenida se realizó un análisis utilizando estadística descriptiva frecuentista y estadística inferencial con chi cuadrado. Se utilizó el programa SPSS versión 25 o JAMOVI.
Resultados
Características de los pacientes
Se operaron un total de 23 pacientes de meningiomas de base de cráneo en el periodo estudiado (tabla 1). De ellos un 95% (n 22) fueron de sexo femenino. Con respecto a la edad fueron menores de 40 años un 21.7 % (n:5), entre 40 y 60 años un 39.1% (n:9) y mayores de 60 un 39.1% (n:9). Un 73.9% (n:17) tuvieron manifestación clínica y el 26% se encontraban asintomáticos en el momento del diagnóstico.
Características del tumor
La localización más frecuente fue anterolateral con un 47.8% (n:11), luego los posteriores con un 30.4% (n:7), los anteriomediales 17.4% (n:4) y por último mediales 4.3% (n:1). Fueron menores de 3 cm un 4.3% (n:1) de los tumores, midieron entre 3 y 5 cm un 78.3% (n:18), y más de 5 cm un 17.4% (n:4); siendo menores de 5 cm un 82.6% (n:19).
Un 73.9 % (n:17) de tumores no tuvieron embolización previa a la cirugía
Características imagenológicas del tumor
Un 52.2% (n:12) de los meningiomas tenían edema perilesional y un 17.4% (n:4) presentaban calcio intratumoral. En un 8.7% (n:2) se pudo constatar invasión ósea. Un 34.8% (n:8) eran hiperintensos en T2, 43.5% (n:10) isointensos y de características hetorogeneas un 21.7% (n:5). Con respecto a su comportamiento en secuencia T1 un 30.4% (n:7) era hipointensos y 69.6% (n:16) isointensos.
Grado de exéresis
Se logró una resección Simpson I en un 4.3% (n:1) de pacientes, Simpson II en un 47.8% (n:11) de pacientes, Simpson III y IV en un 21.7% (n:5) respectivamente, y Simpson V en un 4.3% (n:1).
Tabla 1: Frecuencia y porcentaje de las variables
Frecuencia |
Porcentaje |
|
CLINICA |
||
Sintomático |
17 |
73,9 |
Asintomático |
6 |
26,1 |
EDAD |
||
<40 |
5 |
21,7 |
40-60 |
9 |
39,1 |
>60 |
9 |
39,1 |
LOCALIZACION |
||
Anteromedial |
4 |
17,4 |
Anterolateral |
11 |
47,8 |
Medial |
1 |
4,3 |
Posterior |
7 |
30,4 |
TAMAÑO |
||
<3 cm |
1 |
4,3 |
3-5 cm |
18 |
78,3 |
>5 cm |
4 |
17,4 |
EMBOLIZACION |
||
No |
17 |
73,9 |
Si |
6 |
26,1 |
EDEMA PERILESIONAL |
||
No |
11 |
47,8 |
Si |
12 |
52,2 |
CALCIO |
||
no |
19 |
82,6 |
Si |
4 |
17,4 |
INVASION OSEA |
||
No |
21 |
91,3 |
Si |
2 |
8,7 |
T2 |
||
Hiper |
8 |
34,8 |
Iso |
10 |
43,5 |
heterogeneo |
5 |
21,7 |
T1 |
||
Iso |
16 |
69,6 |
Hipo |
7 |
30,4 |
GRADO DE EXERESIS |
||
I |
1 |
4,3 |
II |
11 |
47,8 |
III |
5 |
21,7 |
IV |
5 |
21,7 |
V |
1 |
4,3 |
Resultados estadísticos
Con respecto a los resultados inferenciales, se realizaron dos tipos de análisis mediante la prueba Chi-cuadrado.
Por un lado, las variables de estudio fueron asociadas con el grado de exéresis medido con la escala de Simpson tomando los diferentes cinco niveles I, II, III, IV y V (tabla 2). Sólo se encontraron asociaciones con la localización y el tamaño, con tamaños del efecto moderados y altos (V de Crammer).
Tabla 2: Asociación de variables con grado de Simpson.
(p) |
|
Localización |
0,002 |
Edad |
0,238 |
Clínica |
0,487 |
Tamaño |
0,001 |
Embolización |
0,724 |
Edema |
0,172 |
Calcio |
0,600 |
Invasión ósea |
0,096 |
T2 |
0,427 |
T1 |
0,213 |
Por otro lado, se asociaron las variables con las medidas de la escala de Simpson divididas como resección total (I, II y III) resección parcial (grado IV y V) (tabla 3). De esta forma, se encontraron asociaciones entre invasión ósea y grado, con tamaños del efecto moderados y altos (V de Crammer). No se encontraron asociaciones entre el resto de las variables con la escala de Simpson (p > .05).
Tabla 3: asociación con resección total o subtotal.
(p) |
|
Edad |
0,814 |
Clínica |
0,091 |
Localización |
0,131 |
Tamaño |
0,089 |
Embolización |
0,638 |
Edema |
0,408 |
Calcio |
0,231 |
Invasión ósea |
0,013 |
T2 |
0,705 |
T1 |
0,226 |
Escala propuesta
Dado los resultados objetivados y descritos con anterioridad, se encontraron tres variables con significación estadística a partir del análisis inferencial: el tamaño tumoral, la localización e invasión ósea.
Para la escala decidimos utilizar las tres variables: localización (anterior 1 punto, posterior 2 puntos, medial 2 puntos y medial que involucra seno cavernoso 3 puntos), tamaño (<5 cm 1 punto, >5 cm cm 2 puntos) e invasión ósea (no 1 punto y si 2 puntos) (tabla 4).
Tabla 4: Escala prequirúrgica
Localización |
anterior |
1 |
posterior |
2 |
|
|
medial |
2 |
medial(C) |
3 |
|
Tamaño |
< 5 cm |
1 |
> 5 cm |
2 |
|
Invasión ósea |
No |
1 |
Si |
2 |
Siendo el puntaje mínimo 3 y el máximo 7. Se consideró como alta la probabilidad de resección total con un puntaje de 3, moderada con puntaje de 4 y baja con puntaje de 5 o más (tabla 5).
Tabla 5: puntaje de escala
Grado |
Puntaje |
Alto |
3 |
Moderado |
4 |
Bajo |
>5 |
Del total de nuestra serie (tabla 6) 11 tuvieron un puntaje de 3 puntos y su totalidad tuvo resección total (Simpson I, II y III); 10 pacientes un puntaje de 4, 6 de ellos con resección total y 4 con resección subtotal. Por último, 2 pacientes tuvieron un puntaje de 5 y ambos tuvieron resección subtotal (Figura 2).
Tabla 6: puntaje de pacientes de nuestro estudio.
Total (n) |
Resección total |
Resección subtotal |
|
3 puntos |
11 |
11 |
0 |
4 puntos |
10 |
6 |
4 |
5 puntos |
2 |
0 |
2 |
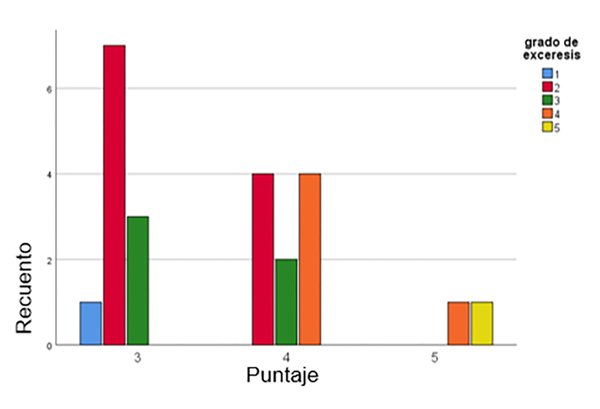
Figura 2: pacientes con distintos grados de exéresis medido en Simpson y su relación con el puntaje obtenido de nuestra escala.
Al realizar un análisis inferencial se observó asociación entre la escala realizada y el grado de resección (p: 0,005) (tabla 7 y 8).
Tabla 7 y 8: asociación entres escala propuesta y grado de resección.
Significación asintótica (bilateral) |
|
Chi-cuadrado de Pearson |
0,005 |
DISCUSIÓN
En nuestra serie se operaron 23 pacientes en el periodo 06/2018 - 06/2022; dentro las variables analizadas encontramos que tanto la localización, el tamaño y la invasión ósea del meningioma se relacionaban con el grado de resección. Del total de pacientes estudiados se logró una exéresis completa (Simpson I, II y III) en un 73.8%.
En distintas publicaciones se mostró correlación entre la localización de los meningiomas y el grado de exéresis alcanzado, siendo la base de cráneo el sitio en que menos resección completa se logra.11 Meling. y col. en un estudio de 1148 pacientes, hallaron que en el 68% de los meningiomas de base de cráneo lograron una exéresis total, en comparación con un 89% logrado en los tumores de otra localización.12
En nuestro estudio los meningiomas de base de cráneo anteromedial y anterolateral (que forman en su conjunto la base de cráneo anterior) fueron los de mejor grado de exéresis obtenido, medido en escala de Simpson. Actualmente hay revisiones en que describen más resecabilidad en tumores de base anterior en comparación con aquellos de base media o posterior.13
Si bien cuando hablamos de base de cráneo anterior no podemos obviar el avance del abordaje transnasal endoscópico para el manejo de esta patología, y aunque no deja de haber controversias, hay estudios en los que se ha observado un aumento en el grado de resección en el abordaje transcraneano y menores comorbilidades en comparación con el abordaje endoscópico14. De todas formas, en los de pequeño tamaño el abordaje endoscópico transnasal para muchos equipos neuroquirúrgicos suele ser la indicación primaria.15
En nuestra serie el tamaño del meningioma se relacionó con el grado de exéresis, más de un 78% de los tumores menores de 5 cm tuvieron una resección completa. Varios estudios tomaron como corte 5 cm para hablar de meningiomas de gran tamaño y describieron que, sobre todo en base de cráneo, el tamaño influye en el grado de exéresis.16-18
La invasión ósea puede ser un predictor preoperatorio de la extensión de la resección quirúrgica.19 Una serie que incorporó datos de 1469 meningiomas y analizó factores predictivos relacionados con la extensión quirúrgica de la resección concluyó que la clínica, la ubicación en la base del cráneo y la invasión ósea fueron predictores significativos de un bajo grado de resección (Simpson IV y V).20
En nuestra muestra se observó asociación entre invasión ósea y grado de exéresis, todos los pacientes con invasión (8%) tuvieron una resección subtotal.
Distintos estudios describieron que en los pacientes de edad avanzada los resultados posoperatorios desfavorables se relacionan más con el estado funcional previo y las comorbilidades y no tanto con el grado de exéresis medido en Simpson.21-23 Sin embargo, el principal predictor de un mal resultado funcional posquirúrgico son las complicaciones intraoperatorias en sí, que se observan en un mayor porcentaje en pacientes añosos.24 Por lo cual la resección subtotal con citorreducción adecuada a cambio de una mayor seguridad para los meningiomas localizados cerca de estructuras neurovasculares complejas, suele ser preferible en estos pacientes. En nuestro estudio no se observó una relación entre el grado de Simpson y la edad.
Si bien en este trabajo no se observó relación entre la clínica del paciente, es decir si se encuentra sintomático o asintomático en el momento del diagnóstico, con el grado de exéresis; en un estudio reciente20 los pacientes sintomáticos lograron un grado de exéresis más bajo en comparación con los asintomáticos.
En nuestros resultados la embolización prequirúrgica no se relacionó con el grado de resección. En la revisión realizada no se encontró ningún beneficio directo asociado al grado de exéresis de meningiomas embolizados antes de la operación.25 Ha habido intentos de objetivar la mejor indicación de embolización prequirúrgica y sus beneficios según el tamaño y la vascularización del meningioma. Se ha realizado recientemente un índice de vascularización midiendo el vacío de flujo del meningioma obtenido de un T2 volumétrico, y se observó un mejor control del sangrado en pacientes con alto índice y con embolización previa en comparación con los no embolizados26.
Según la bibliografía entre el 38 y el 67 % de los meningiomas tiene edema perilesional.27 No encontramos relación entre el grado de exéresis y la presencia de edema en los tumores dentro de nuestro trabajo. Vignes et al en estudio de 30 pacientes en donde relaciona el edema y el pronóstico en la cirugía de los meningiomas, concluye que la presencia de edema afecta el pronóstico quirúrgico y confiere un mayor riesgo de morbilidad y complicaciones postoperatorias, pero no realizaron una correlación directa entre meningiomas con edema perilesional y grado de exéresis.28 Si se ha observado que un alto volumen de edema se correlaciona con una mayor incidencia de recurrencia, independientemente del tipo biológico y el grado histológico.29
Aproximadamente el 15 % de los meningiomas pueden presentar diferentes patrones de calcificación. Zhang et al30 en un reporte de 58 casos logaron una resección Simpson Grado I-II en 52 casos y III en 6. La calcificación se asoció con meningiomas de alto grado y se ha demostrado que los tumores no calcificados pueden tener un mayor potencial proliferativo que los tumores calcificados31. En nuestro estudio no se observó relación entre el grado de resección y el calcio intratumoral.
Dado la importancia que tiene conocer el tipo de consistencia tumoral a la hora de abordar esta patología, se ha intentado predecir la misma en estudios prequirúrgicos, así como se han propuesto scores intraoperatorios.32 Hay diversos trabajos que relacionaron la hiperintensidad en T2 con tumores blandos; la misma puede estar relacionada con un mayor contenido de agua. Mientras que la señal más baja en T2 para tumores duros podría deberse a menos agua y más contenido de colágeno y calcio. Aunque hay varios artículos que muestran el indicio de la señal T2 para predecir la consistencia, todavía no es un método validado.33
Así mismo, en la mayoría de los trabajos revisados no se ha encontrado que exista una asociación entre T1 y la consistencia del meningioma. Sin embargo, Hoover et al encontró que los meningiomas que eran hiperintensos en T2 e hipointensos en T1 tenían más probabilidad de ser blandos, mientras que los que eran hipointensos en T2 e isointensos en T1 probablemente eran firmes.34 La elastografía es una técnica nueva que aprovecha el hecho de que un proceso patológico altera las propiedades elásticas del tejido afectado. Este cambio en la elasticidad se detecta y se visualiza mediante RM utilizando ondas transversales para evaluar el desplazamiento del tejido en todas las direcciones.35 La elastografía demostró tener un buen grado de precisión a la hora de predecir la consistencia de los meningiomas así como de otro tipo de tumores.36 Si bien aún no se encuentra disponible, es una herramienta a tener en cuenta cuando su accesibilidad deje de ser limitada.37
En nuestro análisis ya se la hiperintensidad en T2 o la hipointensidad en T1 no se correlacionaron con el grado de exéresis; y analizando luego a los pacientes en que se combinaban hiperintensidad en T2 e hipointensidad en T1 tampoco se observó relación con la resección.
Dado que el pronóstico y la sobrevida del paciente difiere notablemente si el meningioma es grado I, II o III de la OMS, es importante saber que muchos factores que complejizan la resección total también son factores que se asocian con sospecha de malignidad. La clínica, el tamaño, el edema perilesional, la irregularidad y heterogeneidad, así como aspectos imagenológicos basados en el ADC, mostraron ser factores que aumentan la probabilidad de malignidad del meningioma; así como la localización fuera de base cráneo.38-40 Dentro de las diferentes características el tamaño es el único que tuvo importancia estadística a la hora de la resección subtotal en nuestra serie.41
Se observo que la recurrencia de los meningiomas, independientemente de su localización, varía según el grado de malignidad solo a partir de una resección Simpson IV.
Si bien propusimos una escala con datos prequirúrgicos, el aporte de los estudios de histomoleculares nos da un pronóstico más adecuado, por lo cual es preciso tenerlos en cuenta. Los estudios que se centran en los factores que predicen la recurrencia del meningioma después de la resección subtotal sugieren que la reducción al mínimo del volumen tumoral residual de menos de 4 a 5 cm3 podría estar asociada con una mayor supervivencia libre de recurrencia. El objetivo debe ser minimizar el volumen residual de modo que sea susceptible de radiocirugía posoperatoria. Algunos autores incluso han demostrado que la combinación de radioterapia con resección subtotal se asocia con tasas de supervivencia libre de recurrencia y global similares a las de la resección total.42
Luego del análisis estadístico propusimos una escala de graduación preoperatoria, con la cual según el puntaje total obtenido podemos inferir la probabilidad de exéresis total. Para la escala utilizamos la localización, el tamaño y la invasión ósea como parámetros (Figura 3, 4 Y 5).
Dentro de localización, los meningiomas de seno cavernoso tuvieron un puntaje superior (3 puntos). La justificación de esta particularidad se basa en que, dado la dificultad y las complicaciones que implican la cirugía, la tendencia actual es la descompresión seguida de radiocirugía.43
Se han intentado realizar con anterioridad distintas escalas.44
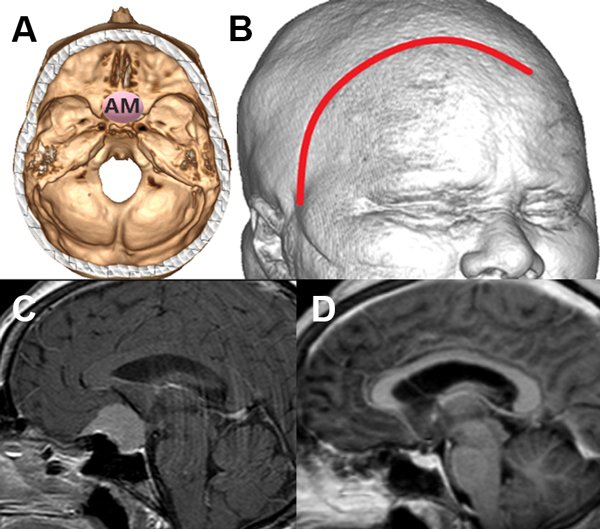
Figura 3: Paciente con meningioma de base de cráneo anteromedial (AM) (1 punto), tamaño menor de 5 cm (1 punto), sin invasión ósea (1 punto), puntaje total: 3, alta probabilidad de resección total. A: localización de lesión en base de cráneo. B: reconstrucción 3D con abordaje. C: resonancia con contraste corte sagital prequirúrgica. D: resonancia con contraste corte sagital posquirúrgica con resección total.
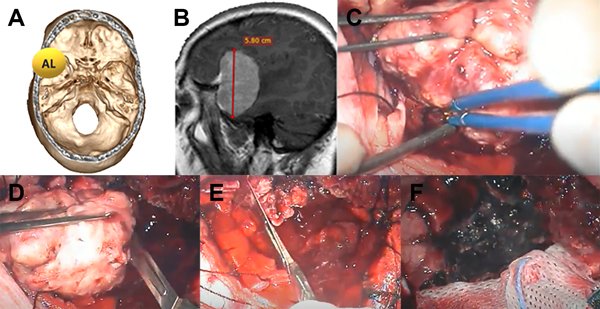
Figura 4: Paciente con meningioma de base de cráneo anterolateral (AL) (1 punto), tamaño más de 5 cm (2 puntos) sin invasión ósea (1 punto), total: 4 puntos, moderada probabilidad de resección total. A: localización de lesión en base de cráneo. B: resonancia con contraste corte sagital prequirúrgica. C: imagen intraoperatoria en donde se observa meningioma con plano aracnoideo. D: vaciamiento y reducción de tamaño con bisturí hoja 11. E: resección parcial de duramadre y coagulación de la misma. F: lodge quirúrgica sin remanente tumoral, resección Simpson 2.
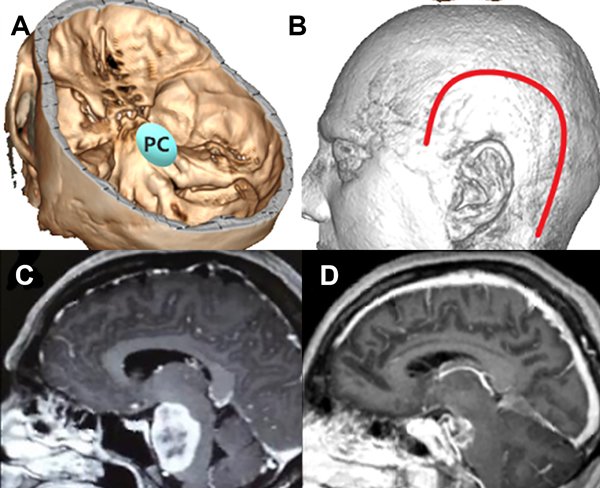
Figura 5: Paciente con meningioma de base de cráneo petroclival (PC) (2 puntos), en su diámetro máximo midió 5 cm (2 puntos) sin invasión ósea, total: 5 puntos, baja probabilidad de resección total. A: localización de lesión en base de cráneo. B: abordaje realizado combinado. C: resonancia con contraste corte sagital prequirúrgica. D: resonancia con contraste corte sagital posquirúrgica con resección subtotal de lesión.
Una de los más difundidas es el de Magitll. y col. de los meningiomas de tuberculum sellae. Propusieron una puntuación basada en el tamaño del tumor, la invasión del canal óptico y el encapsulamiento arterial que podría predecir el EOR (extent of resection) y los resultados visuales posoperatorios. Utilizó al igual que nosotros el tamaño tumoral, pero observaron que un tamaño tumoral más bajo se asoció significativamente con una visión mejor o estable después de la operación, no así con la extensión de la resección.45
Si bien con las particularidades del tumor que nos hacen llegar a un puntaje bajo o alto ya se puede deducir si la cirugía va o no a brindar una resección total; pensamos que, con una escala sencilla, fácil de realizar y con información que se obtiene sin mucha complejidad dentro de la evaluación prequirúrgica se puede dicotomizar el resultado esperado rápidamente y de esa forma planificar la cirugía teniendo en cuenta objetivos realistas. También nos puede ayudar para saber que herramientas, ya sean diagnosticas, intraquirurgicas y posquirúrgicas se pueden llegar a requerir. Teniendo como fin brindarle al paciente un tratamiento adecuado y con la menor morbilidad posible.
CONCLUSIÓN
Dentro de los procedimientos más complejos de la especialidad neuroquirúrgica, sin duda, se encuentran las cirugías de los meningiomas de base de cráneo. Lograr el mayor grado de resección con la menor morbilidad posoperatoria siguen siendo los objetivos perseguidos en este tipo de cirugía. Teniendo en cuenta las diferentes particularidades del tumor, así como del del paciente y sus comorbilidades, muchas veces no solo es necesario si no que es beneficioso realizar una resección subtotal. Para obtener buenos resultados brindando una planificación individualizada, es importante tener en cuenta las distintas características que influyen en la cirugía y que nos permiten predecir el grado de exéresis, y de esta forma adelantarnos a los resultados quirúrgicos y el requerimiento de tratamiento adyuvante.
En nuestro estudio se mostró una relación estadísticamente significativa entre la localización (0,002), el tamaño (0,001) y la invasión ósea (0,013) del meningioma con el grado de exéresis conseguido. Propusimos una escala sencilla para poder medir la posibilidad de resección total tomando en cuenta estas variables
Limitaciones
Dado el bajo número de pacientes (n23) por tratarse de una patología poco frecuente puede que las asociaciones entre variables estén sesgadas, y lleven a una alta probabilidad de cometer error de tipo II (que existan diferencias, pero no puedan ser detectadas por los análisis inferenciales), y una baja potencia estadística. Conjuntamente, comprendemos sus limitaciones al tratarse de un estudio observacional retrospectivo.
El autor no declara conflicto de intereses
No recibió financiamiento
Este es un artículo de acceso abierto bajo la licencia CC BY-NC https://creativecommons.org/licenses/by-nc/4.0/
BIBLIOGRAFÍA